
根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化 钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案,验证其中的Na2CO3和Na2O。在答题卡上写出实验步骤、预期现象和结论。(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡
| 实验操作 | 预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用。 | 有不溶的黑色固体。 |
| 步骤2:取适量步骤1清液于试管中,
|
|
| 步骤3: |
|
(2)假设产物为Na2CO3、Na2O和C的混合物,为进一步测定产物中Na2CO3的含量,进行了以下实验:
步骤1:准确称取w克试样,溶解、过滤后准确配制成250mL溶液。
步骤2:准确量取25.00mL所配溶液于锥形瓶中,滴加几滴指示剂A,滴加c mol/L的标准盐酸至溶液的pH约为8.2(碳的主要存在形式为HCO3—),消耗盐酸的体积为V1mL;再滴加几滴甲基橙,继续用上述盐酸滴至溶液由黄色变橙色,消耗盐酸的体积为V2mL。
步骤3:重复实验3次。滴定结果如下
| 滴定 次数 | 待测溶液 的体积/mL | 消耗标准盐酸的体积 | |
| V1/mL | V2/mL | ||
| 1 | 25.00 | 15.02 | 4.97 |
| 2 | 25.00 | 14.98 | 5.03 |
| 3 | 25.00 | 13.21 | 6.75 |
①步骤2中,第一步滴定所使用的A指示剂为 ,滴定终点的现象为 。
②计算Na2CO3的质量分数= (用含w、c的代数式表示)
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
血液中有一种含铜的呈蓝色的蛋白质分子,其相对分子质量为151 000,已知该分子中铜的质量分数为
0.34%,则平均每个该蛋白质分子中的铜原子数为( )
A.8 B.6
C.4 D.2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性:H2SO4 > 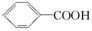 >H2CO3>
>H2CO3> 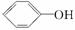 > HCO3—,综合考虑反应物的转化率和原料成本等因素,将
> HCO3—,综合考虑反应物的转化率和原料成本等因素,将  转变为
转变为 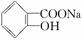 的最佳方法是( )
的最佳方法是( )
A.与稀H2SO4共热后,加入足量的NaOH溶液
B.与稀H2SO4共热后,加入足量的Na2CO3溶液
C.与足量的NaOH溶液共热后,再通入足量CO2
D.与足量的Na OH溶液共热后,再加入适量H2SO4
OH溶液共热后,再加入适量H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
5-氯-2,3-二氢-1-茚酮是合成新农药茚虫威的重要
中间体。
已知: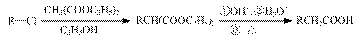
以化合物A(分子式为C7H7Cl)为原料合成5-氯-2,3-二氢-1-茚酮(化合物F)工艺流程如 下:
下:
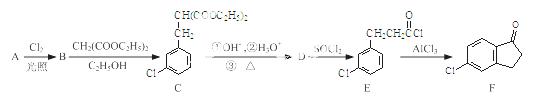
(1)写出反应A→B的化学方程式: ▲ 。
(2)化合物F中含氧官能团的名称为 ▲ ,反应B→C的类型为 ▲ 。
(3)某化合物是D的同分异构体,能使FeCl3溶液显紫色,且分子中只有3种不同化学环境的氢。写出该化合物的结构简式: ▲ (任写一种)。
(4)E→F的转化中,会产生一种与F互为同分异构体的副产物,其结构简式为 ▲ 。
(5)根据已有知识并结合相关信息,写出以化合物F和CH2(COOC2H5)2为有机反应原料制备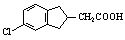 的合成路线流程图(注明反应条件)。合成路线流程图示例如下:
的合成路线流程图(注明反应条件)。合成路线流程图示例如下:
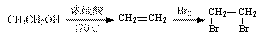
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下面三个数据:①7.2×10-4 ②4.6×10-4 ③4.9×10-10,分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:NaCN+HNO2===HCN+NaNO2;NaCN+HF===HCN+NaF;NaNO2+HF===HNO2+NaF。由此可判断下列叙述中,正确的是( )
A.HF的电离平衡常数是①
B.HNO2的电离平衡常数是①
C.HCN的电离平衡常数是②
D.HNO2的电离平衡常数是③
查看答案和解析>>
科目:高中化学 来源: 题型:
欲使0.1mol·L-1的NaHCO3溶液中c(H+)、c(CO )、c(HCO
)、c(HCO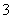 )都减少,其方法是( )
)都减少,其方法是( )
A.通入二氧化碳气体
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式为 ,关于它的叙述中不正确的是( )
,关于它的叙述中不正确的是( )
A.该有机物能使溴的四氯化碳溶液褪色
B.该有机物发生消去反应可得到芳香烃
C.该有机物在一定条件下可发生氧化反应
D.1 mol该有机物最多可与1 mol NaHCO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
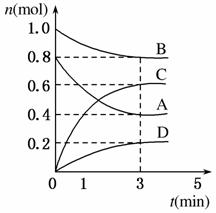
T ℃时,在容积为0.5 L的密闭容器中发生如下反应。mA(g)+nB(g)pC(g)+qD(s) ΔH<0(m、n、p、q为最简整数比)。A、B、C、D的物质的量变化如图所示。
(1)前3 min,v(C)=______________。
(2)当下列物理量不再发生变化时,表明该反应已达到平衡状态的是________(填选项字母)。
A.混合气体的压强
B.混合气体的密度
C.混合气体的平均相对分子质量
D.B的物质的量
E.混合气体的总物质的量
(3)T ℃时,该反应的平衡常数K=________。
(4)反应达到平衡后,下列措施对A的转化率无影响的是________(填选项字母)。
A.保持体积不变,再通入2 mol A和1 mol B
B.移走一部分D
C.把容器的体积缩小一倍
D.升高温度
(5)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)________v(逆)(填“>”“<”或“=”),判断的依据是_________________________________________________ _______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com