
| A、①②④⑤ | B、③⑥ |
| C、②④⑤ | D、②④⑥ |


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
| A、合金的熔点一般比组分金属低 |
| B、铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na) |
| C、铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出 |
| D、若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若反应中转移的电子为nmol,则0.15<n<0.25 |
| B、n(Na+):n(Cl-)可能为7:3 |
| C、与NaOH反应的氯气一定为0.3mol |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+ Na+ Cl- NO3- |
| B、Cu2+ H+ HCO3- Cl- |
| C、Na+ Ba2+ Cl- SO42- |
| D、Fe2+ H+ NO3- ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
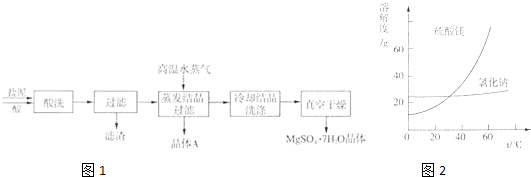
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com