
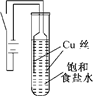
 某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液 |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
| A、K2CO3═2K++CO32- |
| B、NaHSO4═H++SO42-+Na+ |
| C、KHCO3═K++H++CO32- |
| D、NH4Cl═NH4++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用数轴表示分散系的分类: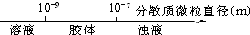 |
| B、已知氯酸钾与蔗糖(C12H22O11)反应的产物为KCl、CO2和水,则氧化产物与还原产物的物质的量之比为2:3 |
| C、10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% |
| D、可以用Ba(OH)2和焰色反应鉴别NaHCO3、NaCl、KCl、K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
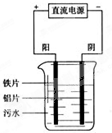 电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.
电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )| A、催化剂b表面的反应是CO2+2H++2e-═HCOOH |
| B、催化剂a表面发生氧化反应,有O2产生 |
| C、催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| D、该过程是将太阳能转化为化学能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺的状况 |
| B、大量使用化肥和农药,以提高农作物产量 |
| C、含磷化合物的排放是“水华”和“赤潮”产生的原因 |
| D、安装煤炭“固硫”装置,降低酸雨发生率 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、容器Ⅰ、Ⅱ的右室中SO3的体积分数相同 |
| B、容器Ⅰ、Ⅱ的右室中反应速率I<II |
| C、平衡时容器Ⅰ、Ⅱ中的隔板均应在中间 |
| D、容器II若为绝热容器(隔板不导热),则容器II右室中SO2的转化率与左室SO3的转化率之和小于1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com