

图2-6
A.上述可逆反应的正反应为放热反应 B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态 D.上述反应的逆反应的ΔH>0
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
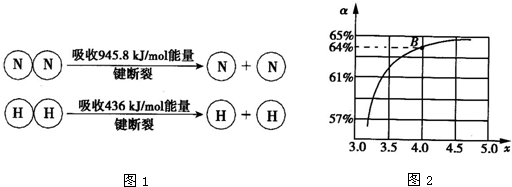
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
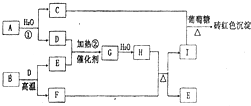 (2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,
(2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2012?宜春模拟)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同.气体成分可能含SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式.实验用到的仪器如图所示:
(2012?宜春模拟)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同.气体成分可能含SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式.实验用到的仪器如图所示:| 实验 小组 |
称取CuSO4 的质量/g |
仪器C增 加的质量/g |
量筒中水的体积折算标 准状况下气体的体积/mL |
| ① | 6.4 | 2.56 | 224 |
| ② | 6.4 | 2.56 | 448 |
| ||
| ||
| 10 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
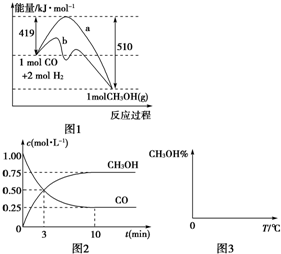 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.| 3 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com