
【题目】A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)填写下列空白:
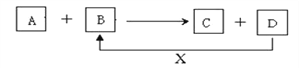
(1)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式_________,并写出偏铝酸钠溶液中通入过量二氧化碳的离子方程式________________________
(2)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式__________________。
科目:高中化学 来源: 题型:
【题目】对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
酸 | 电离平衡常数K |
CH3COOH | 1.76×10﹣5 |
H2CO3 | K1=4.3×10﹣7 K2=5.61×10﹣11 |
H3PO4 | K1=7.52×10﹣3 K2=6.23×10﹣8 K3=2.20×10﹣13 |
回答下列问题:
(1)从电离的角度,HCO ![]() 、HPO
、HPO ![]() 、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
(2)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在由水电离产生的H+浓度为1×10﹣13molL﹣1的溶液中,一定能大量共存的离子组是( )
A.K+、Cl﹣、NO ![]() 、S2﹣
、S2﹣
B.Na+、Ca2+、Cl﹣、HCO ![]()
C.K+、Ba2+、Cl﹣、NO ![]()
D.SO ![]() 、Mg2+、I﹣、S2O
、Mg2+、I﹣、S2O ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法正确的是( )
A. 该合金中铜与镁的物质的量之比是1∶2
B. 该浓硝酸中HNO3的物质的量浓度是13.0 mol/L
C. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D. NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种化合物由M、X两种元素组成,已知A中M元素的质量分数为44.0%,B中M元素的质量分数为34.5%,A的化学式为MX2,则B的化学式为 ( )
A. MX B. M2X3
C. MX3 D. MX4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJmol﹣1
则CO还原Fe2O3的热化学方程式为
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同温度条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1
测得CH3OH的物质的量随时间变化如下图所示,回答问题: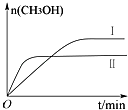
①该反应的平衡常数表达式K=;
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为:KⅠKⅡ(填“>”、“=”或“<”).
③下列措施中能增大CO2转化率的是 . (填序号)
A.升高温度B.充入He(g)使体系压强增大
C.将H2O(g)从体系中分离 D.再充入一定量CO2
④下列图象正确且能表明在t时刻反应一定处于平衡状态的是 . (填序号)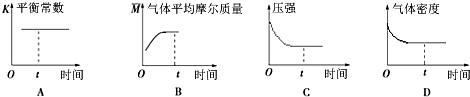
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程从海带中提取碘单质。
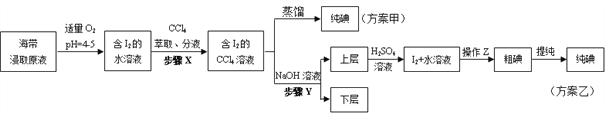
已知:3I2+6NaOH=5NaI+NaIO3+3H2O,根据以上流程,判断下列说法不正确的是( )
A. 方案甲采用蒸馏法不合理主要由于碘易升华,会导致碘的损失
B. 步骤X中,萃取后分液漏斗内观察到的现象为液体分上下两层,上层呈紫红色
C. 步骤Y中,应控制NaOH溶液的浓度和体积
D. 步骤Y的目的将碘转化成离子进入水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中,不符合生产实际的是( ) 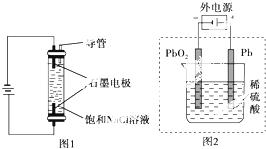
A.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
B.在镀件上电镀锌,用锌作阳极
C.用如图1装置生产家用消毒液(NaClO)
D.用如图2装置为铅蓄电池充
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com