
分析 ①C2H6O(g)+3O2(g)═2CO2(g)+3H2O(g)△H1
②H2O(g)═H2O(l)△H2;
③C2H6O(g)═C2H6O(l)△H3
根据盖斯定律①-③+3×②计算.
解答 解:①C2H6O(g)+3O2(g)═2CO2(g)+3H2O(g)△H1
②H2O(g)═H2O(l)△H2;
③C2H6O(g)═C2H6O(l)△H3
根据盖斯定律①-③+3×②得,C2H6O(l)+3O2(g)═2CO2(g)+3H2O(l)△H=△H1-△H3+3△H2,所以1mol C2H6O(l)完全燃烧生成液态水,则放出的热量为-(△H1-△H3+3△H2),故答案为:-(△H1-△H3+3△H2).
点评 本题主要考查盖斯定律的应用,难度不大,注意基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 $\stackrel{合适的氧化剂}{→}$
$\stackrel{合适的氧化剂}{→}$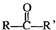 (注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
(注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
 .
. 或
或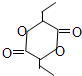 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取25.0mL蒸馏水 | B. | 用分液漏斗分离乙醇和水 | ||
| C. | 用烧杯溶解FeCl3固体试样 | D. | 用托盘天平称量NaCl固体5.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CuSO4固体 | B. | 加入少量CH3COONa固体 | ||
| C. | 加入少量NH4HSO4固体 | D. | 加入少量Na2CO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(Na+)>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH${\;}_{4}^{+}$)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾是由大量燃烧煤、天然气、石油等产生的CO2偏高所致 | |
| B. | 绿色化学的核心是开发应用新技术,加大对环境污染的治理能力 | |
| C. | 用催化氧化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| D. | 加酶无磷洗衣粉的使用,可以降低水体污染(如海洋的赤潮) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ②③⑥⑦ | C. | ④⑤⑥⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com