
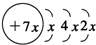 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则. .
. 分析 A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
解答 解:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,则E为Fe元素.
(1)由上述分析可知,A为Si、B为Na、C为P、D为N,
故答案为:Si;Na;P;N;
(2)上述五种元素中,N的非金属性最强,Na的金属性最强,故HNO3的酸性最强,NaOH的碱性最强,
故答案为:HNO3;NaOH;
(3)同周期自左而右,第一电离能呈增大趋势(个别除外),所以第一电离能最大的元素是F,周期自左而右,电负性增大,故电负性最大的元素是F,
故答案为:F;F;
(4)D的氢化物NH3、C的氢化物为PH3,因为NH3分子间能形成氢键,使NH3的沸点高于PH3的,
故答案为:高;NH3分子间形成氢键;
(5)E为Fe元素,E的核外电子排布式为1s22s22p63s23p63d64s2,故核电荷数是26,Fe在周期表中处于第四周期第Ⅷ族,在周期表中处于d 区,
故答案为:26;四、Ⅷ;d;
(6)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子,所以其核外电子排布图为: ,这样排布遵循了泡利不相容原理、洪特规则,
,这样排布遵循了泡利不相容原理、洪特规则,
故答案为: ;泡利;洪特;
;泡利;洪特;
(7)B的硫化物为Na2S,用电子式表示形成过程: ,
,
故答案为: .
.
点评 本题结构性质位置关系应用,涉及元素周期律、核外电子排布规律、氢键、常用化学用语等,推断元素是解题的关键,注意同周期第一电离能异常情况.


科目:高中化学 来源: 题型:选择题
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 相同条件下,pH=5的①NH4C1溶液、②CH3C00H溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③ | |
| C. | 体积相同、浓度均为0.1mol/L的盐酸和醋酸,分别稀释m倍、n倍,溶液的pH都变成5,则m<n | |
| D. | pH=5的硫酸溶液稀释到原来的500倍,稀释后溶液中的c(SO42-)与c(H+)之比约为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的还原性依次减弱 | B. | I、Br、Cl的非金属性性依次增强 | ||
| C. | C、N、O 的原子半径依次增大 | D. | P、S、Cl的最高正化合价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦ | B. | ②⑤⑧ | C. | ③⑥⑨ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
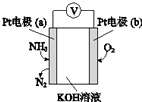 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
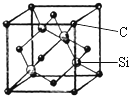 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
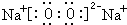 .X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.
.X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com