
| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | 亚硫酸钠溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.先发生盐酸与NaOH的反应;
B.常温下,Al遇浓硝酸发生钝化;
C.NaOH过量,开始不生成沉淀;
D.发生氧化还原反应.
解答 解:A.先发生盐酸与NaOH的反应,然后盐酸与碳酸钠反应生成碳酸氢钠,最后盐酸与碳酸氢钠反应生成气体,则现象不合理,故A错误;
B.常温下,Al遇浓硝酸发生钝化,则不能观察到红棕色气体,现象不合理,故B错误;
C.NaOH过量,开始不生成沉淀,反应生成偏铝酸钠和氯化钠,开始无现象,故C错误;
D.亚硫酸钠与高锰酸钾发生氧化还原反应,溶液褪色,现象合理,故D正确;
故选D.
点评 本题考查物质的性质及实验装置的综合应用,为高频考点,把握物质的性质、发生的反应、反应与现象的关系为解答的关键,侧重分析与实验能力的综合考查,综合性较强,题目难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、Cl- | B. | K+、MnO4-、Br-、Cl- | ||
| C. | Na+、Cl-、NO3-、SO42- | D. | Al3+、NH4+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家为实现“低碳”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:
科学家为实现“低碳”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单气态氢化物的热稳定性:Y<W | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | Z和W的简单离子具有相同的电子层结构 | |
| D. | 化合物ZX2中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径R>W>Y>Z | |
| B. | 气态氢化物稳定性:HmW<HnR | |
| C. | Z2Y2电子式可表示为  | |
| D. | RY2和W2均有漂白性,将两者等物质的量混合溶于水,漂白性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
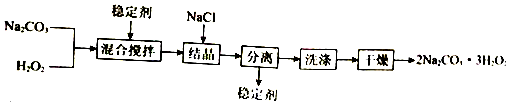
| A. | 可以用MnO2作稳定剂 | |
| B. | “结晶”时,加入NaCl的主要作用是增大产品的产率 | |
| C. | “分离”所用的主要玻璃仪器为烧杯、漏斗、玻璃棒 | |
| D. | 2Na2CO3•3H2O2受热分解属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
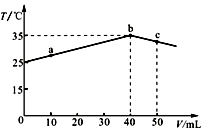
| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | b点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.23×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com