
| A. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-2119.6kJ/mol | |
| B. | C2H6(g)+$\frac{5}{2}$O2(g)═2CO(g)+3H2O(g)△H=-1559.8kJ/mol | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g)△H=-1559.8kJ/mol | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol |
分析 表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物;依据3.0g乙烷完全燃烧在常温下放出的热量为155.98kJ,结合燃烧热的定义计算求出1mol乙烷完全燃烧放出的热量,然后写出热化学方程式.
解答 解:燃烧热是指:在25℃、101KPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量;
3.0g乙烷完全燃烧在常温下放出的热量为155.98kJ,则1mol乙烷,质量为30g,完全燃烧生成稳定的氧化物放出的热量为10×155.98kJ=1559.8KJ,
其燃烧热的热化学方程式为C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol,
故选:D.
点评 本题考查了燃烧热的概念以及燃烧热的热化学方程式的书写,注意燃烧热的热化学方程式中可燃物的物质的量为1mol,产物必须是稳定的氧化物,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | △H>0、△S>0的反应在任何温度下都不能自发进行 | |
| B. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据 | |
| D. | 在其它外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 离子半径:X>Y>Z | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释10倍后,溶液的pH=4 | |
| B. | c(SO32-)+c(OH-)=c(H2SO3)+c(HSO3-) | |
| C. | 2c(SO32-)+c(HSO3-)+c(H2SO3)=0.02mol•L-1 | |
| D. | $\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$约为5×10-5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. .
.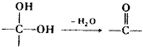 ②
② 中氯原子较难水解物质A(
中氯原子较难水解物质A( )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 +2Cl2
+2Cl2
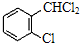 +2HCl、
+2HCl、 +2NaOH
+2NaOH
 +2NaCl+2H2O.
+2NaCl+2H2O. 和
和 .
. ,两个取代基分别在间位和对位,共3种
,两个取代基分别在间位和对位,共3种
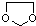 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热蒸干,灼烧都得到Al2O3 | |
| B. | 25℃时,Mg(OH)2固体在蒸馏水、盐酸和氯化铵溶液中的Ksp大小顺序为:盐酸>氯化铵>蒸馏水 | |
| C. | 已知25℃时,NH4F溶液显酸性,则电离常数K(NH3•H2O)<K(HF) | |
| D. | 向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合溶液中,c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 | |
| B. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成大量的SO3 | |
| D. | 富含硫黄的矿物在工业上可用于制造硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com