
【题目】某学习小组为探究MnO2与FeCl3·6H2O的反应,设计了下列装置:

查阅文献有如下信息:①FeCl3 熔点282℃,沸点315℃, 2FeCl3 ![]() 2FeCl2+Cl2↑
2FeCl2+Cl2↑
②FeCl6·6H2O 熔点37℃,沸点285℃
实验过程记录:
操作步骤 | 现象 |
1.检查装置气密性,添加相应药品, 点燃酒精灯,开始给试管A加热 | |
2.打开a,关闭b、c, 用湿润的蓝色石蕊试纸贴近a口 | A中出现白雾,蓝色石蕊试纸变红 |
3.打开b,关闭a、c | A中逐渐产生黄色气体,试管及导管壁内附有黄色液滴,B中溶液变红 |
4.打开c,关闭a、b | C中溶液变棕黄色 |
5.停止加热 |
回答下列问题:
(1)A中的白雾是________________________。
(2)管壁内形成黄色液滴,可能的原因是______________________。
(3)B中溶液变红,请用离子方程式解释其原因_______________________。
(4)对C中溶液变黄色,小组展开进一步实验:

Ⅰ.C中变黄的原因是___________________________________________。
Ⅱ.C中发生反应的离子方程式是________________________________。
(5)对A中残留物进行分离,其中得到一种不溶于水的红棕色固体,写出A中生成该固体的化学方程式____________________________________。
(6)在A中MnO2发生的化学反应为__________________________________。
【答案】 盐酸水液滴 FeCl3·6H2O受热气化,在管壁遇冷所致 Fe3++3SCN-=Fe(SCN)3 Fe3+和I2共同导致 2I-+ Cl2=I2+2Cl- 2FeCl3·6H2O![]() Fe2O3+6HCl↑+9H2O↑ MnO2 +4HC1
Fe2O3+6HCl↑+9H2O↑ MnO2 +4HC1![]() Cl2↑ +MnCl2 +2H2O
Cl2↑ +MnCl2 +2H2O
【解析】(1)FeCl36H2O 受热失去结晶水FeCl36H2O![]() FeCl3+6H2O,同时水解FeCl3+3H2OFe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾;(2)因为FeCl36H2O 的沸点282℃,所以加热会使FeCl36H2O气化,在管壁遇冷又转变成液体,所以试管及导管壁内附有黄色液滴;(3)FeCl3溶液中滴入KSCN溶液,发生络合反应,Fe3++3SCN-=Fe(SCN)3,生成血红色的硫氰化铁,所以B中溶液变红;(4)根据以上分析,C中变黄是Fe3+和I2的颜色,则证明有物质能够将I-氧化成I2,未检查到Fe2+,则证明铁离子不能氧化碘离子,二氧化锰与FeCl36H2O 反应生成的Cl2氧化的I-,C中发生反应的离子方程式是2I-+ Cl2=I2+2Cl-;(5)对A中残留物进行分离,其中得到一种不溶于水的红棕色固体,该物质是Fe2O3、反应方程式为:2FeCl3·6H2O
FeCl3+6H2O,同时水解FeCl3+3H2OFe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾;(2)因为FeCl36H2O 的沸点282℃,所以加热会使FeCl36H2O气化,在管壁遇冷又转变成液体,所以试管及导管壁内附有黄色液滴;(3)FeCl3溶液中滴入KSCN溶液,发生络合反应,Fe3++3SCN-=Fe(SCN)3,生成血红色的硫氰化铁,所以B中溶液变红;(4)根据以上分析,C中变黄是Fe3+和I2的颜色,则证明有物质能够将I-氧化成I2,未检查到Fe2+,则证明铁离子不能氧化碘离子,二氧化锰与FeCl36H2O 反应生成的Cl2氧化的I-,C中发生反应的离子方程式是2I-+ Cl2=I2+2Cl-;(5)对A中残留物进行分离,其中得到一种不溶于水的红棕色固体,该物质是Fe2O3、反应方程式为:2FeCl3·6H2O![]() Fe2O3+6HCl↑+9H2O↑;(6)二氧化锰在加热条件下能把浓盐酸氧化为氯气,方程式为 MnO2 +4HC1
Fe2O3+6HCl↑+9H2O↑;(6)二氧化锰在加热条件下能把浓盐酸氧化为氯气,方程式为 MnO2 +4HC1![]() Cl2↑ +MnCl2 +2H2O。
Cl2↑ +MnCl2 +2H2O。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a = b
B.混合溶液的pH = 7
C.混合溶液中,c(H+) = ![]() mol/L
mol/L
D.混合溶液中,c(H+) +c(B) = c(OH) + c(A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL0.1 mol L-1 Na2CO3溶液中逐滴加入0.1 mol L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如下图所示。下列说法正确的是( )
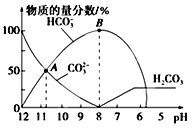
A. A点所处的溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B. 随着盐酸的加入,溶液中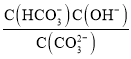 将减小
将减小
C. 随着盐酸的加入,当pH约为6时,溶液中开始放出气体
D. 当溶液的pH为7时,溶液的总体积为40mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验操作或事故处理方法正确的是( )
A. 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿内称量
B. 实验室制取氧气时,先加入药品,然后再检查装置的气密性
C. 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上稀碳酸氢钠溶液
D. 粗盐提纯时,将制得的晶体转移到新制过滤器中用大量水进行洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子可以大量共存且溶液是无色的离子组是
A.H+、Na+、NO3-、Cu2+ B.Ba2+、Mg2+、Cl-、SO42-
C.NO3-、SO42-、K+、Mg2+ D.Mg2+、K+、OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
①Zn为正极,Cu为负极
②H+向负极移动
③Cu极有H2产生
④电子流动方向Zn→Cu
⑤正极的电极反应式是Zn-2e-=Zn2+
⑥若有1mol电子流过导线,则理论上产生0.5 mol H2
(1)卡片中记录合理的是___________(填序号)
(2)该电池总反应的离子方程式是___________________________
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是_____________ (填“锌极”或“铜极”)
Ⅱ.某温度时,在2 L密闭容器中,三种气态物质X、 Y、Z的物质的量(n)随时间(t)变化的曲线如右图所示,可得:
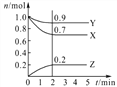
(1)该反应的化学方程式为_____________________
(2)反应开始至2 min,用Y表示的平均反应速率 为_______________
(3)在一定温度下,上述反应达到反应限度的标志的是____________
A. X、Y、Z的浓度相等
B. X、Y、Z的分子数比为3︰1︰2
C. Z的生成速率是Y的生成速率的二倍
D.单位时间内生成n mol Y,同时生成3n mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表揭示了许多元素的相似性和递变规律,下表中所示的一些元素。

(1)写出⑥元素的离子的核外电子排布示意图____________________。
(2)给④⑤⑥⑦⑧形成的单核离子的半径从大到小排序:_________(写离子符号)。
(3)给①②③④⑤⑥⑦⑧⑨的原子半径从大到小排序:__________(写原子符号)。
(4)给②⑥⑨最高价氧化物对应水化物碱性从大到小排序__________(写化学式)。
(5)给③④⑤的非金属性从大到小排序_________(写元素符号)。
(6)③是一种用途十分广泛的非金属,请写出③的最高价氧化物与过量的⑨的氢氧化物反应的化学方程式___________________________________。
(7)⑦号元素的氢氧化物有特殊的化学性质,写出⑦号元素的氯化物与足量的⑥号元素的氢氧化物反应的离子方程式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com