
四种短周期元素A、B、C、D的性质或结构信息如下.
①原子半径大小:A>B>C>D
②四种元素之间形成的某三种分子的比例模型及部分性质如下:

请根据上述信息回答下列问题.
(1)C元素在周期表中的位置 ,请写出D2C2分子的结构式 ,A元素的单质与物质甲发生反应的离子方程式 .
(2)丁物质与乙互为同系物,在相同条件下其蒸气的密度是氢气密度的36倍,且核磁共振氢谱只有
1组峰,写出丁物质的结构简式 .
(3)A与同周期的E元素组成的化合物EA5在热水中完全水解生成一种中强酸和一种强酸,该反应的化学方程式是 .
(4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式 ,一段时间后,测得铁增重128g,此时b极通入气体的体积是 L(标准状况下).

考点: 位置结构性质的相互关系应用;原电池和电解池的工作原理.
专题: 元素周期律与元素周期表专题;电化学专题.
分析: 甲是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,应是H2O,根据结构和用途可知,乙是CH4,丙是强氧化性弱酸,可以用于消毒杀菌,应是HClO,则这四种元素分别为H、C、O、Cl,根据原子半径大小顺序可知A是Cl,B是C,C是O,D是H,根据原子的结构特点推断元素在周期表中的位置,结合物质的性质和原电池原理解答该题.
解答: 解:甲是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,应是H2O,根据结构和用途可知,乙是CH4,丙是强氧化性弱酸,可以用于消毒杀菌,应是HClO,则这四种元素分别为H、C、O、Cl,根据原子半径大小顺序可知A是Cl,B是C,C是O,D是H,
(1)C是O元素,核外有2个电子层,最外层电子数为6,应位于第二周期ⅥA族,D、C形成的化合物D2C2分为H2O2,双氧水为共价化合物,其结构式为:H﹣O﹣O﹣H,Cl2与水反应生成HCl和HClO,其中HCl为强酸,完全电离,HClO为弱酸,反应的离子方程式为Cl2+H2O⇌H++Cl﹣+HClO,
故答案为:第二周期ⅥA族; H﹣O﹣O﹣H;Cl2+H2O⇌H++Cl﹣+HClO;
(2)该烃的蒸气密度是相同条件下氢气密度的36倍,则该烃的相对分子量为:2×36=72,72÷14=5余2,与甲烷互为同系物,故该烷烃为戊烷,核磁共振氢谱只有1组峰,那么该有机物为新戊烷,结构简式为C(CH3)4,故答案为:C(CH3)4;
(3)A是Cl,Cl与同周期的P元素组成的化合物为:PCl5,五氯化磷在热水中完全水解,生成磷酸(H3PO4)和盐酸,则该反应的化学方程式为:PCl5+4H2O=H3PO4+5HCl,故答案为:PCl5+4H2O=H3PO4+5HCl;
(4)CH4具有还原性,在反应中易被氧化而失去电子,作原电池的负极,电极反应式为CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O,串联电路中转移电子相等,所以消耗甲烷的体积=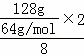 ×22.4L/mol=11.2L,故答案为:CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O;11.2.
×22.4L/mol=11.2L,故答案为:CH4﹣8e﹣+10OH﹣=CO32﹣+7H2O;11.2.
点评: 本题考查了元素的推断、原电池和电解池原理,根据电解池中Cu、Fe电极上发生的反应确定燃料电池中正负极及电极上通入的气体,再结合转移电子相等计算,难点是电极反应式的书写.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 |
|
| B. | 同周期的主族元素从左到右,非金属性逐渐增强,气态氢化物稳定性逐渐增强 |
|
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
|
| D. | 原子最外层电子数大于4的元素一定是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 摩尔是物质的数量单位,含有6.02×1023个微粒的物质叫做1摩尔
B. 1mol氧含有6.02×1023个氧原子
C. 在标准状况下,任何物质的摩尔体积约为22.4L/mol
D. 一定质量的气体的体积随压强增大和温度降低而变小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是()
A. 将过量SO2气体通入氨水中:SO2+2NH3•H2O=2 NH4++SO32﹣+H2O
B. 向FeI2溶液中通入足量的氯气:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
C. 向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH﹣+2HCO3﹣=BaCO3↓+2H2O+CO32﹣
D. 硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3﹣+12H++10I﹣=Fe2++5I2+3NO↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下,某反应达到平衡,平衡常数K=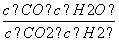 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O
 CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分离或提纯物质的方法正确的是( )
|
| A. | 用蒸馏的方法制取蒸馏水 |
|
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
|
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
|
| D. | 用加热、蒸发的方法可以除去CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中符合图象的是( )

A.N2(g)+3H2(g)2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0)
B.2SO3(g)2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D.H2(g)+CO(g)C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com