
 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
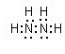 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.分析 (1)碳能与CuO反应置换出Cu;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数作相应的加减;
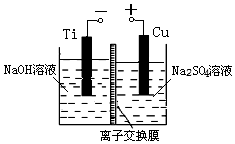
(3)①阴极发生还原反应,氢离子得电子放出氢气;
②阳极发生氧化反应,碱性条件下Cu在阳极失去电子得到Cu2O与H2O;
③Na2SO4溶液的主要作用是增强溶液的导电性;
(4)液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,根据得失电子守恒分析;
(5)肼又称联氨,电子式为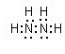 ;肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子;
;肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子;
(6)若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,得到物质的浓度相等N2H5C1和N2H4•H2O,而在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度,所以离子浓度大小为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+),由此解答;
(7)肼-空气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,正极是氧气得到电子生成氢氧根离子.
解答 解:(1)方法Ⅰ反应条件不易控制,若控温不当碳与CuO发生置换反应生成Cu,使Cu2O产率降低,
故答案为:Cu;
(2)已知:①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-akJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-bkJ•mol-1
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
由盖斯定律可知,①-③×2+②得2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=-(a+b-2c)kJ•mol-1;
故答案为:-(a+b-2c)kJ•mol-1;
(3)①阴极发生还原反应,氢离子得电子放出H2,所以还原产物是H2,故答案为:H2;
②阳极发生氧化反应,碱性条件下Cu在阳极失去电子得到Cu2O与H2O,阳极电极反应式为:2Cu-2e-+2OH-=Cu2O+H2O,故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
③Na2SO4溶液的主要作用是增强溶液的导电性,故答案为:增强溶液的导电性;
(4)液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,其反应的方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑;
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑;
(5)肼又称联氨,电子式为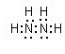 ;肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O=N2H5++OH-,故答案为:
;肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O=N2H5++OH-,故答案为: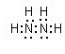 ;N2H4+H2O?N2H5++OH-;
;N2H4+H2O?N2H5++OH-;
(6)若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,得到物质的浓度相等N2H5C1和N2H4•H2O,而在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度,所以离子浓度大小为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+);
(7)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,正极发生还原反应,电极方程式为O2+2H2O+4e-=4OH-,反应过程中生成水,溶液浓度稀释电解质溶液的pH将减小;
故答案为:N2H4+4OH--4e-=4H2O+N2↑;减小.
点评 本题以物质的制备为载体,考查元素化合物性质、盖斯定律、电解原理以及离子浓度的大小比较等,题目难度中等,注意电极反应式的书写.


科目:高中化学 来源: 题型:选择题
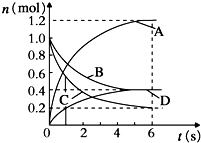
| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的反应速率相等 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入品红溶液中,溶液的红色褪去 | |
| B. | 将5滴氯化铁饱和溶液滴入25mL煮沸的蒸馏水中继续加热,液体变红褐色 | |
| C. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 | |
| D. | 将葡萄糖溶液加入新制Cu(OH)2悬浊液加热至沸腾,出现砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有①② | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
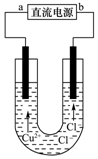
| A. | a端是直流电源的正极 | |
| B. | 阴极上发生的反应:Cu2++2e-=Cu | |
| C. | 通电使CuCl2发生电离 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )| A. | a 电极发生反应:H2NCH2CH2NH2+16e-+4H2O═2CO2↑+N2↑+16H+ | |
| B. | 质子交换膜处H+由右向左移动 | |
| C. | 该电池在微生物作用下将化学能转化为电能 | |
| D. | 开始放电时b极附近pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com