
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有____▲__性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+______▲____。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O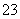 +I2===S4O
+I2===S4O +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:
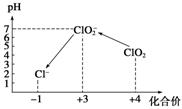
请回答:
①操作Ⅰ中反应的离子方程式是_____________▲_________________。
②确定操作Ⅱ完全反应的现象是_____________▲_________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_______▲___________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____▲____mg·L-1。
【知识点】本题考查氧化还原反应相关知识
【答案解析】(1)氧化(1分) (2)K2SO4(1分) (其余每空各2分) (3)①2ClO2+2I-===2ClO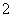 +I2 ②蓝色消失,半分钟内不变色 ③ClO
+I2 ②蓝色消失,半分钟内不变色 ③ClO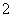 +4I-+4H+===Cl-+2I2+2H2O ④0.675
+4I-+4H+===Cl-+2I2+2H2O ④0.675
解析:(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有氧化性。(2)工业上可以通过下列方法制取ClO2,根据化学反应方程式给出部分:2KClO3+SO2===2ClO2+____可知SO2中S元素必须升高,同时根据守恒关系,则可推知产物为K2SO4,即反应为2KClO3+SO2===2ClO2+K2SO4。(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。可推知Ⅰ中反应的离子方程式是2ClO2+2I-===2ClO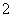 +I2,Ⅱ.加入一定量的Na2S2O3溶液,确定操作Ⅱ完全反应的现象是蓝色消失,半分钟内不变色,Ⅲ.加硫酸调节水样pH至1~3,在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是ClO
+I2,Ⅱ.加入一定量的Na2S2O3溶液,确定操作Ⅱ完全反应的现象是蓝色消失,半分钟内不变色,Ⅲ.加硫酸调节水样pH至1~3,在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是ClO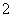 +4I-+4H+===Cl-+2I2+2H2O,若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,由反应关系可知,2S2O
+4I-+4H+===Cl-+2I2+2H2O,若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,由反应关系可知,2S2O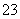 ~I2~2ClO2则水样中ClO2的物质的量为1.0×10-5 mol mol则ClO2的质量是65.7g/mol×10-5 mol。则水样中ClO2的浓度是0,657mg·L-1。
~I2~2ClO2则水样中ClO2的物质的量为1.0×10-5 mol mol则ClO2的质量是65.7g/mol×10-5 mol。则水样中ClO2的浓度是0,657mg·L-1。
【思路点拨】本题考查氧化还原反应相关知识,本题结合化学与生活、化学实验对学生综合考察学生能力,对于高二学生来说属于难题。


科目:高中化学 来源: 题型:
用一定量的铁与足量的稀硫酸及足量的CuO制取单质铜,有人设计了以下两种方案:
①Fe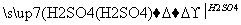 H2
H2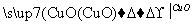 Cu
Cu
②CuO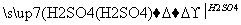 CuSO4
CuSO4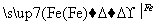 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量为( )
A.一样多 B.①多
C.②多 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述不正确的
A.5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 NA
B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2 NA
C.50 mL 12 mol•L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA
D.常温常压下,46 g NO2 与 N2O4的混合气体中含有的原子总数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列叙述正确的是(Fe 56)
A.1mol•L-1 NaHCO3溶液中的Na+数为NA
B.常温时,2.24LCO2所含的氧原子数为0.2NA
C.5.6g Fe与足量稀盐酸反应,转移电子数为0.2NA
D.标准状况下,2.24L CCl4所含分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀硫酸和硝酸的混合溶液200 mL,
分成两份。向其中一份逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO)。向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如下图所示。
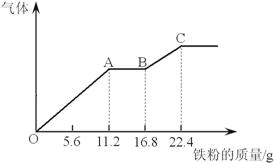
(1)第二份溶液中最终溶质为 ;
(2)OA段产生的气体是 (填化学式),BC段产生的气体是 (填化学式),AB段的反应为 ;
(3)原混合酸中HNO3的物质的量为 mol,H2SO4的物质的量浓度应为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是 ( )
A.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
B.在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-=Cl-+2H++SO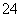
C.在碳酸氢镁溶液中加入过量氢氧化钠溶液:
Mg2++2HCO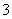 +4OH-=Mg(OH)2 ↓+2CO
+4OH-=Mg(OH)2 ↓+2CO +2H2O
+2H2O
D.在过氧化钠中加入稀硫酸:2Na2O2+4H+=4Na++2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+ 和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应方程式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.铁跟稀H2SO4反应Fe+6H+===2Fe3++H2↑
B.向氯化亚铁溶液中通入氯气Fe2++Cl2===Fe3++2Cl-
C.向氯化铁溶液中加入适量铁粉Fe3++Fe===Fe2+
D.氯化铁溶液跟过量NaOH溶液反应Fe3++3OH-===Fe(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com