
| A. | ⅣA族元素 | B. | ⅤA族元素 | C. | ⅥA 族元素 | D. | ⅦA族元素 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 范德华力 | B. | 共价键 | C. | 氢键 | D. | 离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
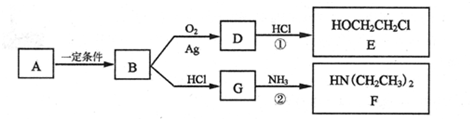
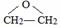 .
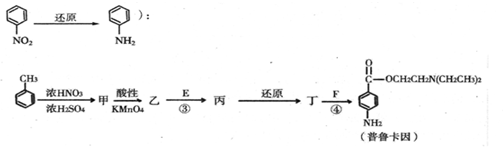
.
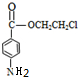 ;
; ;
;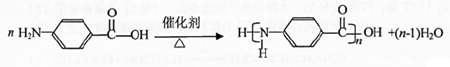 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$X与${\;}_{94}^{240}$Y互为同素异形体 | |
| B. | ${\;}_{94}^{238}$X与${\;}_{92}^{238}$Z互为同素异形体 | |
| C. | ${\;}_{94}^{240}$Y与${\;}_{92}^{238}$Z具有相同中子数 | |
| D. | ${\;}_{94}^{238}$X与${\;}_{92}^{238}$Z具有相同化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+OH-→CO32-+H2O | |
| B. | Ba2++OH-+HCO3-→BaCO3↓+H2O | |
| C. | Ba2++2OH-+2HCO3-→BaCO3↓+CO32-+H2O | |
| D. | 2Ba2++3OH-+3HCO3-→2BaCO3↓+CO32-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水提溴过程中,提取溴单质只能用有机物萃取的方法 | |
| B. | 电解饱和食盐水可制得金属钠 | |
| C. | 海水晒盐过程中主要涉及物理变化 | |
| D. | 海带提碘中,氧化过程可通入过量的氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验时向蒸馏烧瓶中放入几粒沸石(或碎瓷片) | |
| B. | 金属钠着火时使用泡沫灭火器灭火 | |
| C. | 用试管加热碳酸氢钠固体时使试管口略向上倾斜 | |
| D. | 浓硫酸溅到皮肤上立即用稀氢氧化钠溶液冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com