
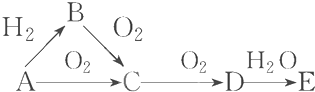
分析 A是气体单质,A能和氢气反应,则A是非金属单质,A能被氧气氧化生成C,C能被氧化生成D,则A在氧化物中是变价元素,E的水溶液显强酸性,则E是非金属性较强的元素,氮气和氢气反应生成氨气,氨气和氧气反应生成一氧化氮和水,氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸是强酸,所以A为N2,B为NH3,C为NO,D为NO2,E为HNO3,据此分析回答.
解答 解:A是气体单质,A能和氢气反应,则A是非金属单质,A能被氧气氧化生成C,C能被氧化生成D,则A在氧化物中是变价元素,E的水溶液显强酸性,则E是非金属性较强的元素,氮气和氢气反应生成氨气,氨气和氧气反应生成一氧化氮和水,氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸是强酸,所以A为N2,B为NH3,C为NO,D为NO2,E为HNO3,
(1)B、D、E分别为:NH3,NO2,HNO3,
故答案为:NH3,NO2,HNO3;
(2)B-C的反应为氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,D-E的反应为3NO2+H2O=2HNO3+NO,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,3NO2+H2O=2HNO3+NO.
点评 本题考查了无机物转化关系和元素化合物的性质,明确物质之间的反应及其性质是解本题关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
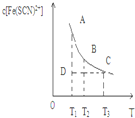 FeCl3与KSCN混合时存在下列平衡:Fe3++SCN-?[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe(SCN)]2+与温度T的关系如图,则下列说法正确的是( )
FeCl3与KSCN混合时存在下列平衡:Fe3++SCN-?[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe(SCN)]2+与温度T的关系如图,则下列说法正确的是( )| A. | FeCl3与KSCN反应的热化学反应方程式为:Fe3++SCN-?[Fe( SCN)]2+△H>0 | |
| B. | 温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1>K2 | |
| C. | 反应处于D点时,一定有V正>V逆 | |
| D. | T2温度下,向B点溶液中加入FeCl3 固体,平衡状态会从 B点变到A点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | f.g.k.m | B. | c.j.k.m | C. | c.h.i.k | D. | f.g.h.j. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
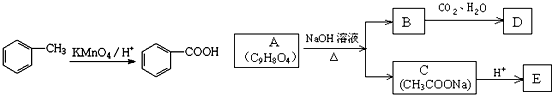
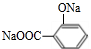 ,
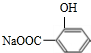
,

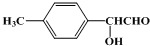 、
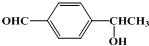
、
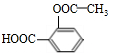 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+2H2O.
+CH3COONa+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A分子的原子的核外电子排布式是1s22s22p63s23p4 | |
| B. | 向D的溶液中加入少量二氧化锰,一定有无色气体生成. | |
| C. | 还原性强弱B>C | |
| D. | 若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是CH4O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液和CO2的反应 | B. | Ba(OH)2溶液和稀硫酸的反应 | ||
| C. | NaOH溶液和稀硫酸反应 | D. | 氨水和稀硫酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 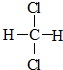 和 和  | B. | CH2=CH-CH=CH2和  | ||
| C. | 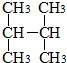 和 和 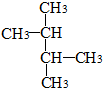 | D. | C(CH3)3C(CH3)3和CH3(CH2)3C(CH3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
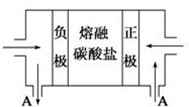 钠及其化合物具有广泛的用途.
钠及其化合物具有广泛的用途.| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaCO | NaCN |
| pH | 8.8 | 9.7 | .6 | 0.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com