
| A. | 氧化还原反应 | B. | 离子反应 | C. | 复分解反应 | D. | 缓慢氧化 |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸、所有中和反应;绝大多数化合反应、置换反应;少数分解、复分解反应;
常见的吸热反应有:个别的化合反应(如C和CO2),绝大数分解反应,少数分解置换以及某些复分解(如铵盐和强碱);
注意放热反应必须是化学反应.
解答 解:A.氧化还原反应不一定是放热反应,如CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO是吸热反应,故A错误;
B.离子反应可能是吸热反应,如盐类水解反应是吸热反应,故B错误;
C.复分解反应不一定是放热过程,如氯化铵和氢氧化钡结晶水合物发生反应为吸热反应,故C错误;
D.缓慢氧化是放热反应,故D正确.
故选D.
点评 本题考查吸热反应和放热反应,难度不大,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的化学方程式:
的化学方程式: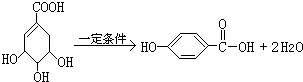 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
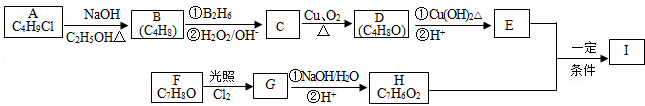
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①⑤⑥ | C. | 只有②④⑥ | D. | 只有③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的气体在标准状况下的体积为4.48 L | |
| B. | 硝酸只起到强氧化性作用 | |
| C. | 被还原的硝酸的物质的量为(0.2-a) mol | |
| D. | 反应后溶液中所含NO3-的物质的量为0.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com