
下列各组顺序排列正确的是
A.密度:Na > K > Li B.热稳定性:HCl > H2S > H2O
C.酸性:H2CO3 < H2SiO3 < HNO3 D.离子半径:F -> A13+ > CI –
科目:高中化学 来源: 题型:
下列各项与化学平衡移动原理无关的是 ( )。
A.收集氯气用排饱和食盐水的方法
B.加催化剂,使N2和H2在一定的条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.加压条件下有利于SO2和O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 。1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为
98%的浓硫酸 mL。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;

(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1)
;
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c= 4.18 J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。

③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A—I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中σ与π键数目比为 B、C、D第一电离能由小到大的顺序为 (填写元素符号)
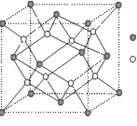 (2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 。
(2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 。
(3)D与G可以形成右图的晶胞,则黑点表示的是 元素(填写元素符号),该元素原子在该晶胞中的配位数为
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的元素更改为另外两种元素,则这个晶胞化学式为 ,若再将留下的所有原子换成另外一种新元素的原子,则成为另外一种晶胞,该晶胞中成键原子键角为 。
(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为 如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为 。(阿伏加德罗常数用NA表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为元素周期表中短周期的一部分,下列说法错误的是
| X | Y |
| Z | W |
A. W的原子序数可能是Y的两倍
B.单质的活泼性可能是Y>Z
C.气态氢化物的稳定性X<Y
D. Y 、W的最高价氧化物对应水化物可能均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
.用某种酸处理高岭石时,会得到一种沉淀,该沉淀由X、Y、Z、W四种短周期元素组成,它的化学式为XYZW6,其中X、Y、Z位于同一周期且最外层电子数依次增大,Y2+与W-具有相同电子层结构,下列说法正确的是
A. 离子半径:Y2+>W- B. 原子半径:X>Y>Z>W
C. 单质沸点:X>Y>Z>W D.四种元素的简单离子均能破坏水的电离平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com