
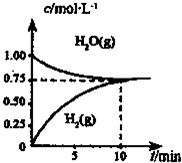
| A.达平衡时,CH4(g)的转化率为75% |
| B.O-10min内,v(CO)=0.075mol?L-1.min-1 |
| C.该反应的化学平衡常数K=O.1875mol?L-1 |
| D.当CH4(g)的消耗速率与H20(g)的生成速率相等,反应到达平衡 |
| 1 |
| 3 |
| 1 |
| 3 |
| 0.25mol/L |
| 1mol/L |
| 1 |
| 3 |
| 1 |
| 3 |
| 0.25mol/L |
| 10min |
| 0.25×0.753 |
| 0.75×0.75 |


科目:高中化学 来源:不详 题型:单选题
| A.反应停止了 | B.容器内气体颜色不变 |
| C.容器内气体总质量不变 | D.容器内气体密度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
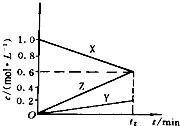
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
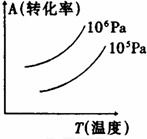
| A.正反应是吸热反应 |
| B.(m+n)<(p+q) |
| C.压强增大,A的转化率减小 |
| D.温度升高,A的转化率减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4molA+2molB |
| B.3molC+1molD+2molA+1molB |
| C.3molC+1molD+1molB |
| D.3molC+1molD |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.平衡右移,K不变,SO2转化率增大 |
| B.平衡右移,K变大,O2转化率减小 |
| C.平衡右移,K不变,O2转化率增大 |
| D.平衡右移,K变大,O2转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com