
| A. | 同周期金属元素的化合价越高,元素的金属性越强 | |
| B. | 海轮外壳上附着一些锌块,可以减缓海轮外壳的腐蚀 | |
| C. | 在含有 BaSO4 沉淀的溶液中加入 Na2SO4固体,c(Ba2+) 增大 | |
| D. | 2NO(g)+2CO(g)═N2(g)+2CO2(g) 在常温下能自发进行,则该反应的△H>0 |
分析 A.同周期金属元素的化合价越高,元素的金属性不一定越强;
B.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
C.硫酸根离子抑制硫酸钡溶解;
D.反应为熵减的反应,根据△H-T△S=△G<0反应自发进行.
解答 解:A.同周期金属元素的化合价越高,元素的金属性不一定越强,如金属性Na>Mg,故A错误;
B.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,Zn、Fe和海水构成原电池,Fe作正极被保护,故B正确;
C.硫酸根离子抑制硫酸钡溶解,所以溶液中钡离子浓度减小,故C错误;
D.正反应为熵减的反应,即△S<0,常温下能自发进行,根据△H-T△S=△G<0反应自发进行,可推知该反应△H<0,故D错误;
故选B.
点评 本题考查较综合,涉及元素周期律、金属腐蚀与防护、难溶物溶解平衡、反应方向判断等知识点,明确反应原理、元素周期律内涵是解本题关键,注意难溶物溶解平衡特点,题目难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
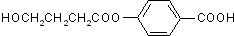 、I
、I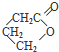 、J
、J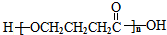 .
. .
. .
.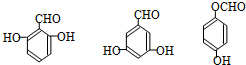 任意一种.
任意一种.查看答案和解析>>
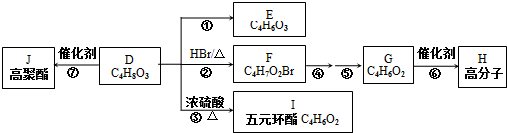
科目:高中化学 来源: 题型:解答题
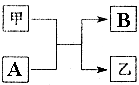 单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:
单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
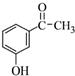 .
.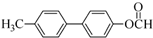 .
. .
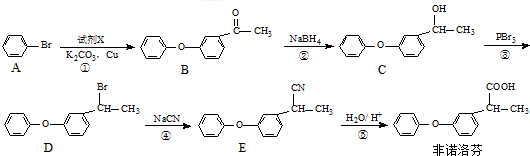
.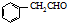 为原料制备
为原料制备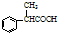 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOC2H5.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOC2H5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
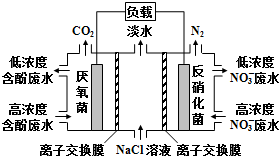
| A. | 右室电极为该电池的正极 | |
| B. | 左室电极反应式可表示为:C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| C. | 右室电极附近溶液的pH减小 | |
| D. | 工作时中间室的Cl-移向左室,Na+移向右室 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com