
| A. | 在水中的溶解度:丙三醇>HOCH2CH2CH2OH>CH3CH2CH2OH>CH2CH2COOCH3 | |
| B. | 密度:CCl4>CHCl3>H2O>苯 | |
| C. | 熔点:2,2-二甲基戊烷>2,3-二甲基丁烷>戊烷>丙烷 | |
| D. | 与金属钠反应的剧烈程度:乙酸>苯酚>乙醇>水 |
分析 A.含-OH越多,溶解性越大,酯不溶于水;
B.液态有机物密度比水小的有烃(烷、烯、炔、芳香烃)、低级酯、一氯代烃、乙醇、乙醛等;密度比水大的有硝基苯、溴苯、四氯化碳、氯仿、溴代烃、乙二醇、丙三醇等,烷、烯、炔等烃类同系物相对密度随着分子内碳原子数的增加的而增大;一氯代烷的相对密度随着碳原子数的增加而减小;
C.烷烃中碳原子个数越多,沸点越大,碳原子个数相同时,支链越多沸点越低;
D.钠与物质产生氢气的快慢取决于羟基氢的活泼性,即物质的酸性越强,则越容易电离出氢离子,与钠反应生成氢气的速率就越快,据此对各选项中的物质羟基的活泼性、酸性强弱进行比较,然后根据与金属钠反应的剧烈程度由强到弱进行顺序;
解答 解:A.含-OH越多,溶解性越大,酯不溶于水,在水中的溶解度:丙三醇>HOCH2CH2CH2OH>CH3CH2CH2OH>CH2CH2COOCH3,故A正确;
B.密度大小:CCl4>CHCl3>H2O>苯,故B正确;
C.烷烃中碳原子个数越多,沸点越大,碳原子个数相同时,支链越多沸点越低,所以2,2-二甲基戊烷>2,3-二甲基丁烷>戊烷>丙烷,故C正确;
D.乙酸为弱酸,酸性大于碳酸,碳酸酸性大于苯酚,水电离出氢离子,乙醇为非电解质不能电离,羟基活泼性乙酸>苯酚>水>乙醇,与金属钠反应的剧烈程度:乙酸>苯酚>水>乙醇,故D错误;
故选D.
点评 本题是一道综合考查题,考查学生烷烃的沸点比较规律、羟基活泼性比较的规律、密度等知识,题目难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:解答题
 一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3molH2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2物质的量随时间变化如图所示.回答下列问题:
一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3molH2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2物质的量随时间变化如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{5}$ | B. | $\frac{1}{4}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素 Y 的简单离子半径比 Z 的小 | |
| B. | 元素 Y 的简单气态氢化物的热稳定性比 W 的弱 | |
| C. | 由 X、Y 组成的物质与由 Y、W 组成的物质反应,反应类型可能为氧化还原反应 | |
| D. | 常温下,Z 的单质一定能溶于由 X、Y、W 三种元素组成的化合物的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ,C中含官能团名称羟基;
,C中含官能团名称羟基; .加聚反应
.加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2 | B. | 3Cu(OH)2•CuSO4 | C. | 2Cu(OH)2•CuSO4 | D. | Cu(OH)2•CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块.小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成.请回答下列问题:
某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块.小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成.请回答下列问题:| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设II不成立 |
| ②再滴入几滴0.01mol/L KSCN 溶液 | 溶液不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电解精炼铜时,当电路中通过的电子数为 2NA 时,阳极质量减少 64 g | |
| B. | 标准状况下,11.2 L 苯中含有 C-H 键的数目为 3NA | |
| C. | 常温常压下,1 mol 甲基(-CH3)所含电子数为 10NA | |
| D. | 标准状况下,22.4 L CO 和 C2H4 混合气体的总分子数为 NA,质量为 28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某有机物X的键线式为
某有机物X的键线式为 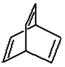
 ,该芳香烃Z在常温常压下与溴水发生反应,写出生成物的结构简式
,该芳香烃Z在常温常压下与溴水发生反应,写出生成物的结构简式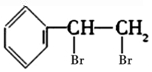 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com