
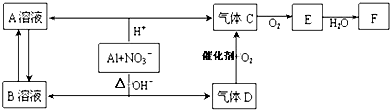
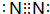
分析 酸性溶液中铝被氧化生成Al3+,在碱性溶液中被氧化生成AlO2-,在酸性溶液中NO3-被还原生成NO,在碱性溶液中被还原生成氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸,然后结合元素化合物性质及化学用语来解答.
解答 解:酸性溶液中铝被氧化生成Al3+,在碱性溶液中被氧化生成AlO2-,在酸性溶液中NO3-被还原生成NO,在碱性溶液中被还原生成氨气,氨气催化氧化可以生成一氧化氮和水,一氧化氮可以和氧气反应生成二氧化氮,故A为硝酸铝,B为偏铝酸盐,C为NO,D为氨气,E为二氧化氮,F为硝酸.
(1)A和B两溶液混合铝离子与偏铝酸根离子水解:Al3++3AlO2-+6H2O=4Al(OH)3↓,生成Al(OH)3,故答案为:Al(OH)3;
(2)氨气可以和一氧化氮或是二氧化氮发生氧化还原反应生成无毒气体单质为N2,电子式为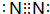 ,故答案为:
,故答案为: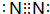 ;
;
(3)由以上分析可知,铝在碱性条件下与NO3-反应的离子方程式为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑,
故答案为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑;
(4)氨水属于弱碱,即使过量也不能溶解氢氧化铝,反应离子方程式为:3NH3•H2O+Al3+═Al(OH)3↓+3 NH4+,
故答案为:3NH3•H2O+Al3+═Al(OH)3↓+3 NH4+;
(5)D生成C属于氨的催化氧化,反应方程式为:4 NH3+5O2$\frac{\underline{催化剂}}{△}$ 4NO+6 H2O,
故答案为:4 NH3+5O2$\frac{\underline{催化剂}}{△}$ 4NO+6 H2O;
(6)NO难溶于水,NO2溶于生成NO,所以除去NO中混有的NO2的方法是通入水中,反应方程式为:3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
(7)在反应中铝失去3个电子,NO3-的还原产物是NO,化合价由+5价降低到+2价,得到3个电子,依据得失电子守恒可知,Al与被还原的NO3-的物质的量之比是1:1,
故答案为:1:1.
点评 本题考查图框题有关物质的转化问题,侧重Al及其化合物转化的考查,明确发生的氧化还原反应推断各物质为解答的关键,难度中等.


科目:高中化学 来源: 题型:解答题
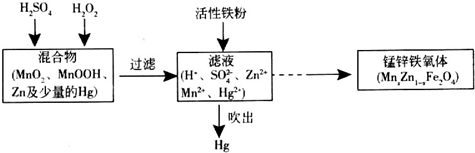
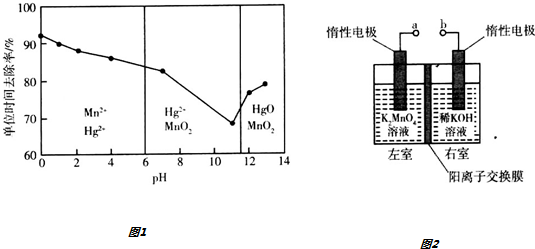
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

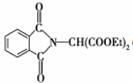 .
.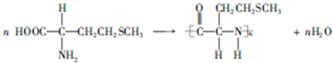 .
. .
.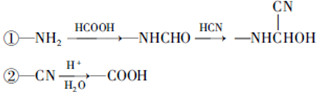
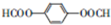
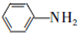 和HCOOH为原料制备化合物
和HCOOH为原料制备化合物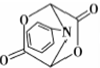 的流程如下:
的流程如下: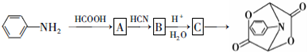
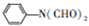 ,C
,C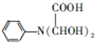 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
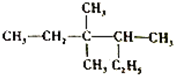
| A. | 2-乙基-3,3-二甲基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,3-甲基-4乙基戊烷 | D. | 2,3,3-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 在101 kPa,298 K条件下,1 mol S和2 mol S的燃烧热相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
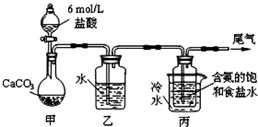 碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.
碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}^{+}}{K}$ | B. | $\frac{Mg}{Ca}$ | C. | $\frac{{O}^{2-}}{N{a}^{+}}$ | D. | $\frac{Cl}{C{l}^{-}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com