
| A、x=1 |
| B、达到平衡时,在相同温度下容器内混合气体的压强是反应前的8.5倍 |
| C、平衡时A的浓度为1.50?L-1 |
| D、B的转化率为20% |
| 3mol |
| 4mol |
| 1mol |
| 5mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
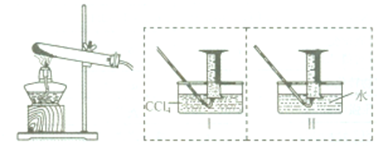
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期表中位于金属和非金属非界线附近的元素属于过渡元素 |
| B、短周期元素中,元素符号用一个大写英文字母表示的元素共有7种 |
| C、第三周期元素的最高正化合价等于它所处的主族序数 |
| D、共价化合物中各原子都一定满足最外层8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下: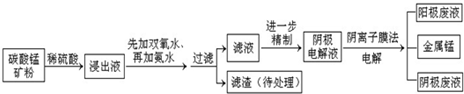
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、800℃下,该反应的化学平衡常数为0.25 |
| B、427℃时该反应的平衡常数为9.4,则该反应的△H>0 |
| C、800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% |
| D、800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
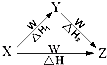 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是①C、CO ②AlCl3、Al(OH)3③Fe、Fe(NO3)2④Na2CO3、NaHCO3( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是①C、CO ②AlCl3、Al(OH)3③Fe、Fe(NO3)2④Na2CO3、NaHCO3( )| A、①②③④ | B、①② |
| C、③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.8mol/(L?S) |
| B、v(B)=0.3mol/(L?S) |
| C、v(C)=0.5mol/(L?S) |
| D、v(D)=60mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com