
| A. | 向HA溶液中逐滴加入少量NH3•H2O,$\frac{c({H}^{+})}{c({A}^{-})}$逐渐增大 | |
| B. | 常温下,0.1mol•L-1 HA溶液中水电离的c(H+)为10-13mol•L-1 | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol•L-1 NaA溶液水解常数为10-9 |
分析 A.向HA溶液中逐滴加入少量NH3•H2O,生成NH4A,氢离子浓度减小;
B.HA为弱酸,则氢离子浓度小于0.1mol/L,水电离的氢离子浓度大于10-13mol/L;
C.根据混合液中的物料守恒判断;
D.NaA的水解平衡常数K=$\frac{c(HA)•c(O{H}^{-})}{c({A}^{-})}$=$\frac{{K}_{w}}{K(HA)}$,据此带入数据计算即可.
解答 解:A.向HA溶液中逐滴加入少量NH3•H2O,生成NH4A,氢离子浓度减小,c(A-)增大,所以$\frac{c({H}^{+})}{c({A}^{-})}$逐渐减小,故A错误;
B.由于HA为弱酸,则常温下0.1mol/LHA溶液中氢离子浓度小于0.1mol/L,水电离的c(H+)一定大于$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,故B错误;
C.NaA溶液中加入HCl溶液至恰好完全反应,NaA和HCl的物质的量相等,根据物料守恒可得:2c(Na+)=c(A-)+c(Cl-)+c(HA),故C错误;
D.NaA的水解平衡常数K=$\frac{c(HA)•c(O{H}^{-})}{c({A}^{-})}$=$\frac{{K}_{w}}{K(HA)}$=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9,故D正确;
故选D.
点评 本题考查了离子浓度大小比较、盐的水解原理、弱电解质的电离平衡等知识,题目难度中等,明确影响弱电解质的电离平衡、盐的水解原理的因素为解答关键,注意掌握电荷守恒、物料守恒在判断离子浓度大小中的应用方法.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Hg(l)+H2SO4(aq)=HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 | |
| B. | 在一密闭容器中发生2SO2(g)+O2(g)?2SO3(g)反应,平衡后增大压强,平衡会正向移动,$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$值增大 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
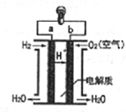
| A. | b极是负极 | B. | 正极发生氧化反应 | ||
| C. | a极的电极反应是H2-2e-=2H+ | D. | 该电池工作时,有淡蓝色火焰产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
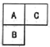 短周期元素A、B、C在元素周期表中的位置关系如图所示,B元素原子的核外电子数等于C元素原子序数的2倍.
短周期元素A、B、C在元素周期表中的位置关系如图所示,B元素原子的核外电子数等于C元素原子序数的2倍.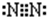 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
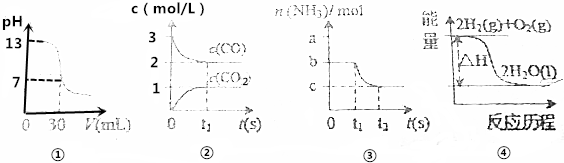
| A. | 图①表示25℃时,0.1000mol•L-1某一元酸滴定25.00mL 0.1000mol•L-1NaOH溶液,则根据图中数据可以计算出该温度下该一元酸的电离常数Ka | |
| B. | 图②表示某温度下的反应2CO(g)?C(s)+CO2(g)中的气体浓度随时间变化的曲线,则根据图中数据可计算该温度下的平衡常数K | |
| C. | 图③表示N2(g)+3H2(g)?2NH3(g)的平衡移动曲线,t1时刻改变的条件可能是降低压强 | |
| D. | 图④表示的反应热△H,可根据H2、O2、H2O的共价键的键能计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | NaCl和HCl | C. | H2O和H2 | D. | KOH和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
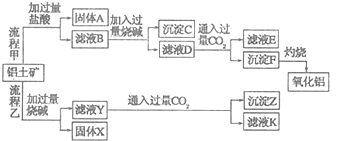
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1]:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com