
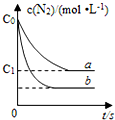
 汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
汽车尾气产生NO的反应为:N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | 曲线b对应的条件改变可能是加入了催化剂 | |
| B. | 温度T下,随着反应的进行,混合气体的密度减小 | |
| C. | 温度T下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应是吸热反应 |
分析 A、催化剂只能改变化学反应色速率,不能改变物质的转化律;
B、此容器为恒容密闭容器,ρ=$\frac{m}{V}$,据此判断即可;
C、依据氮气的浓度变化,找出三段式计算平衡浓度,计算得到平衡常数;
D、由图可知,b曲线化学反应速率快,若是升高温度,氮气的平衡浓度减小,则正反应为吸热反应.
解答 解:A、由图可知,b曲线氮气的平衡浓度减小,故应是平衡发生移动,催化剂只能改变速率,不能改变平衡,故b曲线不可能是由于催化剂影响的,故A错误;
B、反应物和生成物均是气体,故气体的质量m不变,容器为恒容容器,故V不变,那么密度ρ=$\frac{m}{V}$不变,故B错误;
C、N2(g)+O2(g)?2NO(g),
起(mol/L) c0 c0 0
转(mol/L) x x 2x
平(mol/L) c1 c1 2x
解2x=2(c0 -c1 ),故K=$\frac{4({c}_{0}{-c}_{1})^{2}}{{{c}_{1}}^{2}}$,故C正确;
D、由图可知,b曲线化学反应速率快(变化幅度大),氮气的平衡浓度减小,升高温度平衡正向移动,则正反应为吸热反应,即△H>0,故D正确;
故选CD.
点评 本题主要考查的是化学平衡建立的过程,涉及平衡常数的计算、平衡移动原理的应用、催化剂对平衡的影响等,综合性较强,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
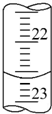 某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
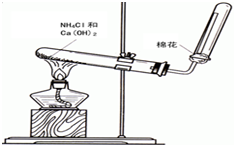 氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
氨气是无色有刺激性恶臭的气味,极易溶于水的气体.如图是实验室制备氨气的装置图.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C中含有14个中子 | |
| B. | 1H、2H、3H是同一种核素 | |
| C. | H2O与D2O(重水)互称同位素 | |
| D. | C60、C70、金刚石、石墨均为碳的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
. ,其名称为3-乙基戊烷.
,其名称为3-乙基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中各物质的浓度相等 | |
| B. | 单位时间内生成2nmolAB同时生成nmolB2 | |
| C. | 单位时间内生成nmolA2同时生成nmolB2 | |
| D. | 单位时间内生成nmolA2同时生成nmolAB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 (任写一种).
(任写一种). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏可得到汽油 | |
| B. | 石油分馏得到的重油经过催化裂化可以得到汽油 | |
| C. | 汽油是烃的混合物,煤油、柴油是由烃构成的纯净物 | |
| D. | 石油裂解是为了获得更多化工原料,如乙烯、丙烯等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com