
| A. | 充电时,电池正极上发生的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O | |
| B. | 充电时,Pb应相连直流电源的正极 | |
| C. | 放电时,负极质量每增重9.6g,溶液中就消耗0.4molH+ | |
| D. | 需要定期补充硫酸 |
分析 该装置放电时,Pb是负极、PbO2是正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,负极反应式为Pb+SO42--2e-=PbSO4,正极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,充电时是电解池,阴极、阳极反应式与负极、正极反应式正好相反,据此分析解答.
解答 解:A.电池放电时,正极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,故A错误;
B.充电时,Pb应相连直流电源的负极相连,硫酸铅还原单质铅,故B错误;
C.放电时,负极质量每增重9.6g,即硫酸根离子的质量为9.6g,物质的量为0.1mol,所以有0.1mol的铅放电,溶液中就消耗0.4molH+,故C正确;
D.由反应可知,原电池放电消耗硫酸生成硫酸铅,充电过程中,硫酸铅生成铅、二氧化铅和硫酸,水蒸发减少,不需要补充硫酸,故D错误;
故选C.
点评 本题考查了二次电池的有关知识,难度中等,注意根据反应方程式判断电解池和原电池,特别是电极反应式的书写,学习中注意体会书写方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
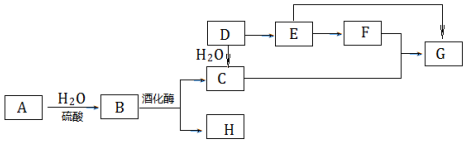
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
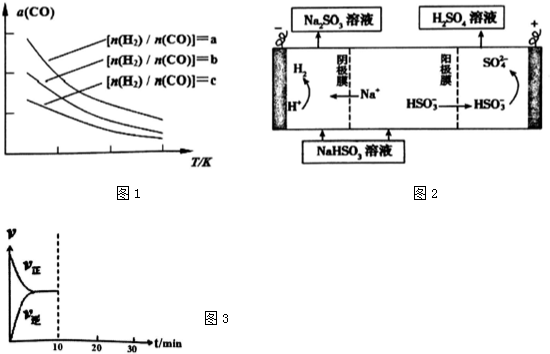
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
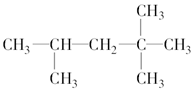 2,2,4-三甲基戊烷
2,2,4-三甲基戊烷 3,4-二甲基己烷
3,4-二甲基己烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦发现抗疟新药青蒿素而获得诺贝尔奖 | |
| B. | 氯气用作自来水的杀菌消毒剂 | |
| C. | 医用消毒酒精中乙醇的浓度(体积分数)为95% | |
| D. | 燃料不完全燃烧排放的CO是大气污染物之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 ml,1mol/LFe2(SO4)3溶液和250mL 3mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2gNaHSO4晶体中阳离子和阴离子的总数为0.03NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中.Na+的物质的量浓度为lmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×l0-15 | B. | 1.0×10-14 | C. | 1.0×10-13 | D. | l.0×l0-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 涤纶、锦纶、蚕丝都属于合成纤维 | |
| B. | 塑料、液晶高分子和合成橡胶被称为三大合成材料 | |
| C. | 用于生产“尿不湿”的高吸水性树脂属于功能高分子材料 | |
| D. | 酚醛树脂是酚类物质和醛类物质加聚而成的高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com