
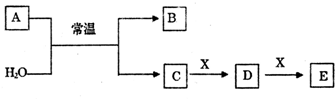
分析 (1)若A为常见的金属单质,焰色反应呈黄色,应为Na,X能使品红溶液褪色,应为SO2,则B为H2,C为NaOH,D为Na2SO3,E为NaHSO3;
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,应为Cl2,则B为HClO,C为HCl;
(3)若A为淡黄色粉末,应为Na2O2,X为非金属单质,通常为黑色粉末,则X为C,根据转化关系可知B为氢氧化钠、C为氧气,D为二氧化碳,E为一氧化碳;
(4)若A为氧化物,X是Fe,溶液D加入KSCN溶液变红,则D中含有铁离子,由转化关系可知C具有强氧化性,则A为NO2,B为NO,C为HNO3,D为 Fe(NO3)3,E为 Fe(NO3)2.
解答 解:(1)若A为常见的金属单质,焰色反应呈黄色,应为Na,X能使品红溶液褪色,应为SO2,则B为H2,C为NaOH,D为Na2SO3,E为NaHSO3,E中含有的化学键类型为离子键和共价键,已知1molNa与水反应放出283.5kJ的热量,则Na与水反应的热化学反应方程式为2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H=-567kJ/mol,
故答案为:离子键和共价键;2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H=-567kJ/mol;
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,应为Cl2,则B为HClO,C为HCl,则Cl2与H2O反应的离子方程式为Cl2+H2O?H++Cl-+HClO,
故答案为:Cl2+H2O?H++Cl-+HClO;
(3)若A为淡黄色粉末,应为Na2O2,X为非金属单质,通常为黑色粉末,则X为C,根据转化关系可知B为氢氧化钠、C为氧气,D为二氧化碳,E为一氧化碳,
①A和水反应方程式为2Na2O2+2H2O=4NaOH+O2↑,该反应中过氧化钠是氧化剂和还原剂,该反应中转移的电子数目为2,则1molA与足量的H2O充分反应时,转移电子总数为 6.02×1023,
故答案为:6.02×1023;
②D为二氧化碳,则D的结构式为O=C=O,故答案为:O=C=O;
(4)若A为氧化物,X是Fe,溶液D加入KSCN溶液变红,则D中含有铁离子,由转化关系可知C具有强氧化性,则A为NO2,B为NO,C为HNO3,D为 Fe(NO3)3,E为 Fe(NO3)2,
①NO2与H2O反应的离子方程式为3NO2+H2O=2 H++2NO3-+NO,
故答案为:3NO2+H2O=2 H++2NO3-+NO;
②D为 Fe(NO3)3,铁离子水解生成氢氧化铁胶体,能净水,反应的离子方程式为Fe3++3H2O=Fe(OH)3 (胶体)+3 H+,
故答案为:Fe3++3H2O=Fe(OH)3 (胶体)+3 H+.
点评 本题考查无机物的推断,是高考中的常见题型,试题综合性强,难度较大,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生分析问题、以及灵活运用基础知识解决实际问题的能力.做好本题的关键之处在于把握好常见物质的性质以及有关转化,并能结合题意具体问题、具体分析即可.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①④⑤ | C. | ①②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
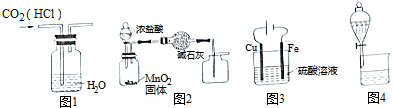
| A. | 用图1所示装置可除去CO2中的HCl | |
| B. | 用图2装置制取并收集干燥纯净的Cl2 | |
| C. | 用图3所示装置将铁保护的方法称为牺牲阳极的阴极保护法 | |
| D. | 用图4装置可分离水和苯,且水层从分液漏斗下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3不溶于水,所以CaCO3不是电解质 | |
| B. | 分解反应不一定是氧化还原反应 | |
| C. | 盐、碱一定含有金属元素 | |
| D. | 在水溶液中电离产生H+的化合物一定是酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com