
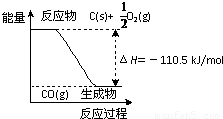
 ×110.5 kJ=55.25kJ,故B错误;
×110.5 kJ=55.25kJ,故B错误;

科目:高中化学 来源: 题型:
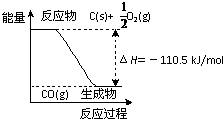 反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )
反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
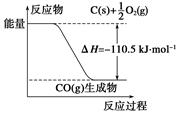
反应2C + O2=2CO 的能量变化如右图所示。下列说法正确的是: ( )
A.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ
B.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
C.该反应的热化学方程式是2C(s) + O2(g)=2CO(g) ΔH=-221 kJ
D.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
[s1] 反应2C + O2=2CO的能量变化如右图所示。下列说法正确的是: ( )
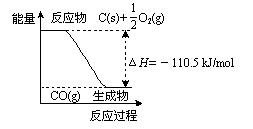 A.12 g C(s)与一定量O2(g)反应生成14 g CO(g),
A.12 g C(s)与一定量O2(g)反应生成14 g CO(g),
放出的热量为110.5 kJ
B.该反应的反应热等于CO分子中化学键形成时所释放的
总能量与O2分子中化学键断裂时所吸收的总能量的差
C.该反应的热化学方程式是
2C(s) + O2(g)=2CO(g) ΔH=-221 kJ
D.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
[s1]11.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com