
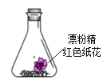
【题目】锥形瓶中装有部分变质的漂粉精粉末和红色纸花,向其中注射浓盐酸,观察到纸花褪色,并有黄绿色气体生成,该实验可以得到的结论是( )
A.说明![]() 具有漂白性B.实验中只发生了氧化还原反应
具有漂白性B.实验中只发生了氧化还原反应
C.浓盐酸被氧化D.反应中生成的气体只有![]()
【答案】C
【解析】
漂粉精粉的有效成分是Ca(ClO)2,放置于空气中吸收二氧化碳生成碳酸钙,所以部分变质的漂粉精粉末由次氯酸钙、碳酸钙和氯化钙组成,加入浓盐酸,盐酸和次氯酸钙发生氧化还原反应生成了黄绿色的氯气,盐酸与碳酸钙发生复分解反应生成二氧化碳,因为生成的氯气中混有水蒸气,含有水蒸气的氯气具有漂白性,所以可观察到纸花褪色,据此分析解答。
A.锥形瓶中装有部分变质的漂粉精粉末和红色纸花,漂粉精没有使红色纸花褪色,所以该实验不能说明Ca(ClO)2具有漂白性,故A错误;
B.部分变质的漂粉精粉末中含有碳酸钙,加入浓盐酸,盐酸和次氯酸钙发生氧化还原反应生成了氯气,盐酸与碳酸钙发生复分解反应生成了二氧化碳,故B错误;
C.浓盐酸中HCl与Ca(ClO)2反应生成氯气,盐酸中Cl的化合价升高,发生氧化反应,盐酸被氧化,故C正确;
D.变质的漂粉精粉末中含有碳酸钙,加入盐酸可生成氯气和二氧化碳气体,故D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碱金属元素按原子序数增大,依次为:锂(![]() )、钠(
)、钠(![]() )、钾(
)、钾(![]() )、铷(
)、铷(![]() )、铯(
)、铯(![]() )、钫(
)、钫(![]() ,放射性元素)。请回答:
,放射性元素)。请回答:
(1) 钠钾合金许多特殊反应中有着非常重要的应用。取![]() 钠钾合金和一定量四氯化碳在一定条件下恰好完全反应,制造出
钠钾合金和一定量四氯化碳在一定条件下恰好完全反应,制造出![]() 纳米级金刚石粉末。则该钠钾合金中钠元素和钾元素的质量比为______。
纳米级金刚石粉末。则该钠钾合金中钠元素和钾元素的质量比为______。
(2)将一定量的铝和过氧化钠混合物投入一盛有![]() 蒸馏水的烧杯中,反应终止时得到一澄清溶液,所得溶液的质量比反应前上述三种物质总质量之和减少
蒸馏水的烧杯中,反应终止时得到一澄清溶液,所得溶液的质量比反应前上述三种物质总质量之和减少![]() ,再向所得溶液中滴加
,再向所得溶液中滴加![]() 盐酸直至产生的沉淀刚好溶解,消耗盐酸
盐酸直至产生的沉淀刚好溶解,消耗盐酸![]() 。求原混合物中
。求原混合物中![]() 和
和![]() 各多少克?____、____
各多少克?____、____
(3)一定条件下,![]() 铷与氧气和臭氧的混合气体
铷与氧气和臭氧的混合气体![]() (已折算为标况,且该混合气体对相同状况下氢气的相对密度为20.8)恰好完全反应,得到两种离子化合物
(已折算为标况,且该混合气体对相同状况下氢气的相对密度为20.8)恰好完全反应,得到两种离子化合物![]() 和
和![]() 的固体混合物。
的固体混合物。![]() 和
和![]() 中,阴阳离子个数比均为
中,阴阳离子个数比均为![]() 且均在两种微粒间作用力。已知
且均在两种微粒间作用力。已知![]() 的含氧量为0.3596。推断化合物
的含氧量为0.3596。推断化合物![]() 、
、![]() 的化学式分别为:____________、____________。
的化学式分别为:____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
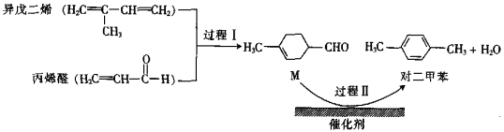
下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
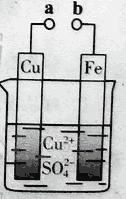
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,横坐标表示通入气体或加入试剂的体积,纵坐标表示产生沉淀的质量。请把符合下列各种情况的图像字母代码分别填入题后。
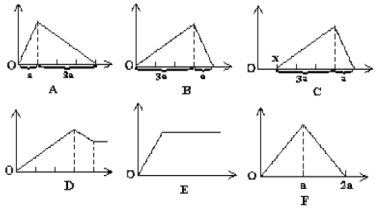
(1)向石灰水中通入二氧化碳:__________。
(2)向AlCl3溶液中加入氨水:__________。
(3)向盐酸和氯化铝的混合溶液中逐滴加入氢氧化钠溶液:__________。
(4)向NaAlO2溶液中滴加盐酸:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KI溶液和FeCl3溶液进行如下实验。下列说法中错误的是 ( )

A.实验i发生的反应为:2Fe3++2I-2Fe2++I2
B.黄色溶液中含有Fe2+、Fe3+、Cl-、K+、I-离子
C.实验ⅲ水溶液中c(Fe2+)小于ⅰ中c(Fe2+)
D.若向实验ⅲ所得液体中滴加![]() 溶液,水层红色比实验ⅱ浅
溶液,水层红色比实验ⅱ浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取![]() 的绿色方法,原理如图所示(已知:
的绿色方法,原理如图所示(已知:![]() ,
,![]() )。下列说法错误的是( )
)。下列说法错误的是( )
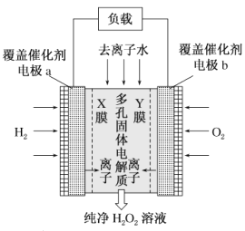
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成![]() 电极上流过
电极上流过![]()
D.b极上的电极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、有机合成等行业。CuCl晶体呈白色,见光易分解,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解氧化为绿色的![]() 。某研究小组以
。某研究小组以![]() (含少量
(含少量![]() )粗品为原料制取CuCl,设计的合成路线如下:
)粗品为原料制取CuCl,设计的合成路线如下:
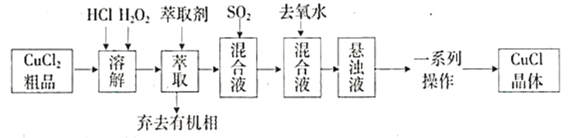
已知:①在较高浓度的盐酸下,![]() 能溶解于甲基异丁基甲酮。
能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:![]()
(1)上述合成路线中,![]() 的作用是________________________,萃取剂为甲基异丁基甲酮,其作用是________________。
的作用是________________________,萃取剂为甲基异丁基甲酮,其作用是________________。
(2)上述合成路线中,![]() 通入混合液的实验装置如图所示:
通入混合液的实验装置如图所示:
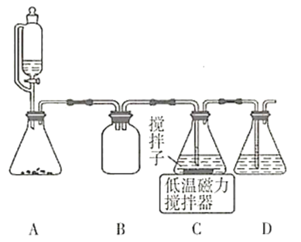
①装置B、D的作用分别是________________________________________________。
②C中反应的离子方程式是___________________________________。
(3)上述合成路线中,向混合液中加入大量去氧水的目的是______________________。
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。
干燥时应注意密封、_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1,2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1,由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________。
(2)贮氢合金ThNi5可催化由CO、H2合成CH4 的反应。已知温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1,温度为T时,该反应的热化学方程式为__________。
(3)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25 ℃,101 kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1 648 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1 2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1 480 kJ·mol-1,FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______。
(4)用O2将HCl转化为Cl2,可提高效益,减少污染。 传统上该转化通过如图所示的催化循环实现,其中,反应①为:2HCl(g)+CuO(s)![]() H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________(反应热用ΔH1和ΔH2表示)。
H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________(反应热用ΔH1和ΔH2表示)。
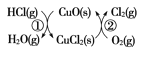
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com