
| A、保持容器体积不变,加入水蒸气 |
| B、将容器的容积缩小一半 |
| C、保持容器容积不变,充入N2使体系压强增大 |
| D、保持压强不变,充入N2使体系容积增大 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、FeCl2溶液(FeCl3):加过量还原铁粉,过滤 |
| B、KNO3溶液(AgNO3):加过量KCl 溶液,过滤 |
| C、NaCl溶液(I2):加CCl4,分液 |
| D、KNO3溶液(NaCl):加热蒸发得浓溶液后,降温、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 事实 | 结论 |
| A | SiO2可用于制光导纤维 | SiO2有导电性 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | Cl2的水溶液可以导电 | Cl2是电解质 |
| D | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠和水反应:2Na2O2+2H2O=4Na++4OH-+O2↑ |
| B、用铜为电极电解饱和食盐水:2Cl-+2H2O=Cl2↑+H2↑+2OH- |
| C、在明矾溶液中滴加过量氨水:Al3++3OH-=Al(OH)3↓ |
| D、向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
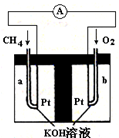 燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”.
燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、充入氦气 | B、分离除乙醇 |
| C、增大压强 | D、升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气体 | 固体反应物 | 选用的酸 | 该酸的作用 | 离子方程式 |
| CO2 | 大理石 | |||
| Cl2 | MnO2 | |||
| H2 | 锌粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com