
【题目】今有X(g)+Y(g) ![]() 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:
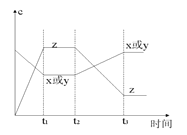
从t2→t3的曲线变化是由哪种条件引起的( )
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
科目:高中化学 来源: 题型:
【题目】下列各组物质在溶液中的反应可用H++OH-===H2O表示的是( )
A.氢氧化钡和硫酸
B.氢氧化铁和盐酸
C.醋酸和氢氧化钠
D.硫酸氢钠和氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反虑结束后的溶液中,逐滴加入5mol/L的NaOH溶液。所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。
则下列说法错误的是:
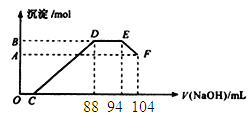
A. 铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为5:4
B. 原硝酸溶液中含硝酸的物质的量为0.5mol
C. B与A的差值为0.05 mol
D. 反应结束后的溶液仍有硝酸剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A.25% B.50% C.75% D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项的两组物质在溶液中的反应,可用同一离子方程式表示的是( )
A.氢氧化钠与盐酸,氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液,Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液,CaCO3溶液与硝酸溶液
D.石灰石与硝酸反应,石灰石与盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A. V(NaOH)=0时,c(H+)=1×10-2mol/L
B. V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C. V(NaOH)=10mL时,c(H+)=1×10-7mol/L
D. V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德埃特尔在哈伯研究所证实了N2与H2在固体催化剂表面合成氨的反应过程。示意图如下(![]()
![]()
![]() 分别表示N2、H2、NH3):
分别表示N2、H2、NH3):
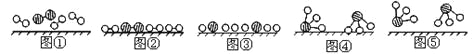
图②表示N2、H2被吸附在催化剂表面,图⑤表示生成的NH3离开催化剂表面,则图③表示 。
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。酸性KMnO4溶液与NaNO2反应的离子方程式是:MnO4-+NO2-+X![]() Mn2++NO3-+H2O(未配平),X表示的粒子是 。酸性高锰酸钾 (“能”或“不能”)鉴别食盐中是否存在NaNO2,理由是___________________
Mn2++NO3-+H2O(未配平),X表示的粒子是 。酸性高锰酸钾 (“能”或“不能”)鉴别食盐中是否存在NaNO2,理由是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分,每空1分)下表是元素周期表的一部分,回答下列有关问题:
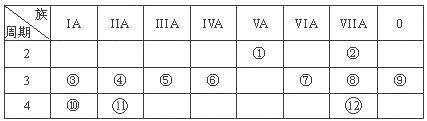
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑧ 。
(3)在①~元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 (用元素符号表示),跟它同周期的ⅦA元素是 (用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式:__________________。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填“>’’、“<’’或“ =’’)》
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。{Ksp[Cr(OH) 3]=6.0×10-31}
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com