
【题目】已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=—24.8kJ·mol-1
②Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) △H=—15.73kJ·mol-1
CO2(g) △H=—15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
A.-218kJ·mol-1B.-109kJ·mol-1C.+218kJ·mol-1D.+109kJ·mol-1
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
Ⅰ.化学上采用![]() 处理
处理![]() 不仅可以消除污染,还可作为工业生产的能量来源。
不仅可以消除污染,还可作为工业生产的能量来源。
(1)工业上可采用![]() 的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。

①该反应历程中正反应的最大活化能为________![]() 。
。
②合成氨反应的热化学方程式为_________________。
(2)不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中![]() 的物质的量分数如图2所示。
的物质的量分数如图2所示。
①M点的![]() ________N点的
________N点的![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
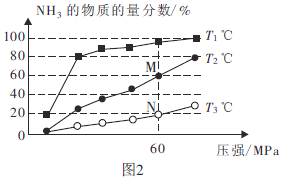
②![]() ℃时,将
℃时,将![]()
![]() 和
和![]()
![]() 充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________
充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________![]() (用最简分数表示)。
(用最简分数表示)。
Ⅱ.废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。
(3)①用次氯酸钠除去氨氮(以![]() 示)的原理如图3所示。写出总反应的化学方程式:______________。
示)的原理如图3所示。写出总反应的化学方程式:______________。

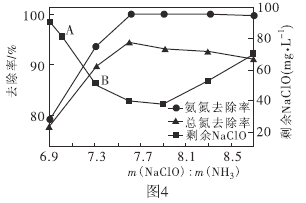
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应相同时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随![]() 的变化情况如图4所示。当
的变化情况如图4所示。当![]() 时,水体中总氮去除率反而下降,可能的原因是________。
时,水体中总氮去除率反而下降,可能的原因是________。
(4)近年来,水体中的硝酸盐含量不断增加。工业上去除废水中硝酸盐的方法是采用电解法将![]() 转化为
转化为![]() ,部分装置如图5所示。
,部分装置如图5所示。

①B电极的电极反应式是________.
②常温下,除去10L废水中的![]()
![]() 后,最终废水的
后,最终废水的![]() ________(电解前后废水的体积变化忽略不计)。
________(电解前后废水的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推是一种重要的学习方法,下列说法不正确的是
A. 已知分子式为C5H12O的醇有8种,则分子式为C6H12O2的羧酸也有8种
B. 已知分子式为C7H14O的酮有15种,则分子式为C7H14O2的酯也有15种
C. 已知丙烷的一氯一溴代物有5种,则分子式为C4H9NO2的氨基酸也有5种
D. 已知金刚烷( )的二氯代物有6种,则金刚烷的十四氯代物也有6种
)的二氯代物有6种,则金刚烷的十四氯代物也有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理超标电镀废水,使其NaCN含量低于0.5 mg/L,即可达到排放标准,反应分两步进行。第一步NaCN与NaClO反应,生成NaOCN和NaCl。第二步NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN是弱酸,易挥发,有剧毒;HCN、HOCN中N元素的化合价相同。下列说法正确的是
A. 处理NaCN超标电镀废水的过程中无元素化合价的改变
B. 第一步反应溶液应调节为酸性,可避免生成有毒物质HCN
C. 第二步发生的反应为2OCN- + 3ClO- ![]() 2CO2↑ + CO32 + 3Cl- + N2↑
2CO2↑ + CO32 + 3Cl- + N2↑
D. 处理100 m3含NaCN 10.3 mg/L的废水实际至少需要50 mol NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
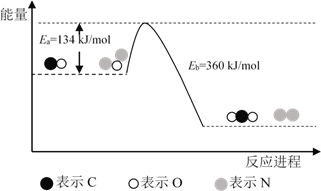
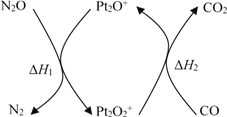
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述中正确的是( )
A.化学反应速率的关系是2υ逆(NH3)=3υ正(H2O)
B.恒容时,混合气体的平均密度保持不变的时候,可以证明达到平衡
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时4υ正(O2)=5υ逆(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
A. 该反应的ΔH < 0 B. 化学平衡常数K增大
C. CO2的转化率增加 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为CuCO3·Cu(OH)2设计从孔雀石中冶炼铜的方案如下:

(1)将孔雀石粉碎的目的是_______,加入过量稀硫酸,可观察到的现象是_______
(2)操作a的名称是_______,在滤液中加入过量铁粉发生的反应有___________(用离子方程式表示)
(3)在悬浊液中加入A的目的是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与50 mL 0.1 mol·L-1的Na2CO3溶液中Na+的物质的量相同的溶液是( )
A.50 mL 0.2 mol·L-1的NaCl溶液B.100 mL 0.2 mol·L-1的NaCl溶液
C.25 mL 0.1 mol·L-1的Na2SO4溶液D.50 mL 0.1 mol·L-1的NaHCO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com