
| A. | 比纯铝熔点高 | |
| B. | 各种成分在自然界中含量丰富,容易获取 | |
| C. | 具有比较活泼的化学性质 | |
| D. | 质量轻,强度大,抗腐蚀能力比较强 |
分析 根据合金的性能可知,铝合金用于京沪高铁,自然从质量轻,强度大,抗腐蚀能力强等方面考虑,与化学性质活泼没有任何关系,再由铝常温下能与空气中氧气反应,生成一层致密的氧化物保护膜,从而具有抗腐蚀性.
解答 解:A、铝合金的熔点比纯铝的低,故A错误.
B、铝元素在地壳中含量占第三位,含量比较丰富,但因铝性质活泼,只能采用电解法制取,成本较高,并不容易获得,故B错误.
C、铝合金的化学性质的确比较活泼,易与空气中氧气反应生成一层致密氧化物起到保护作用,但与被用于制造车厢没有必然联系,故C错误.
D、车厢大部分采用铝合金材料制造,这是因为铝合金具有质量轻,强度大,抗腐蚀能力比较强的优点,故D正确;
故选D.
点评 本题考查了合金的形成、性质分析判断,巧妙完成该题,应题干和选项结合来分析,比较容易完成,属于高考题中的送分题,题目难度不大.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 用CH3CH218OH与CH3COOH发生酯化反应,生成H218O | |
| B. | 反应液混合时,顺序为先倒乙醇再倒浓硫酸最后倒乙酸 | |
| C. | 乙酸乙酯不会和水生成乙酸和乙醇 | |
| D. | 用蒸馏的方法从饱和Na2CO3溶液中分离出乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
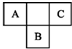 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等. ,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).
,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
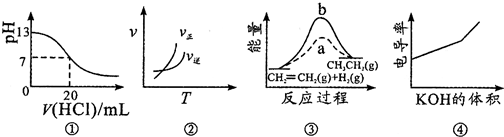
| A. | 图①表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应A2(g)+3B2(g)?2AB3(g)△H<0 | |
| C. | 图③中a、b曲线分别表示反应CH2═CH2(g)+H2(g)═CH3CH3(g)△H<0,使用和未使用催化剂时反应过程中的能量变化 | |
| D. | 电导率是衡量电解质溶液导电能力大小的物理量,图④表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com