
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | |
| B. | 14C的原子结构示意图: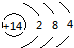 | |
| C. | N2分子的电子式: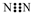 | |
| D. | 乙酸乙酯的结构简式为:CH3COOC2H5 |
分析 A、质量数标在元素符号的左上角;
B、14C的原子核内有6个质子,核外有6个电子;
C、氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键;
D、乙酸乙酯是由乙酸和乙醇经“酸脱-OH,醇脱-H”的反应机理反应得到.
解答 解:A、质量数标在元素符号的左上角,质子数标在左下角,故质量数为35的氯原子为3517Cl,故A错误;
B、14C的核内有6个质子,核外有2个电子层,第一层上有2个电子、最外层上有4个电子,其原子结构示意图为 ,故B错误;
,故B错误;
C、氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键,氮分子的电子式为 ,故C错误;
,故C错误;
D、乙酸乙酯是由乙酸和乙醇经“酸脱-OH,醇脱-H”的反应机理反应得到,故所得的乙酸乙酯的结构简式为:CH3COOC2H5,故D正确.
故选D.
点评 本题考查了同位素的表示方法、原子结构示意图的书写和电子式的书写等,应注意的是互为同位素的原子的原子结构示意图完全相同.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯、乙醇均能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 | |
| C. | 煤制煤气是化学变化,是高效、清洁地利用煤的重要途径 | |
| D. | 乙酸乙酯、油脂、葡萄糖、蛋白质都可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: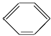 +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ 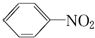 +H2O△H<0
+H2O△H<0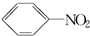 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$ 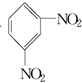 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素符号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 14X可用与测定文物年代 | B. | Z的非金属性比T强 | ||
| C. | Y和T位于同一主族 | D. | X元素形成的化合物种类很多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,使用催化剂能加快反应速率和提高反应物转化率 | |
| B. | 常温下,向水中滴加少量酸形成稀溶液,溶液中c(OH-)和水的离子积常数Kw均不变 | |
| C. | 在锌与足量稀硫酸反应溶液中加入少量铜粉溶液,可以加快反应速率但不影响产生氢气的量 | |
| D. | 在密闭绝热的容器中发生2SO2+O2?2SO3反应,当反应容器温度恒定时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强(对于气体反应),活化分子总数必然增大,故反应速率增大 | |
| B. | 温度升高,分子动能增加,减小了活化能,故反应速率增大 | |
| C. | 选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大 | |
| D. | H+和OH-的反应活化能非常小,反应几乎在瞬间完成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量蒸馏水 | D. | 改用98%的浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com