
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性质超过了单一材料 | |
| C. | 淀粉和纤维素通式都是(C6H10O5)n,都是天然高分子化合物 | |
| D. | 合成纤维的主要原料是石油、天然气、煤等 |
分析 A.纳米为长度单位,不是物质;
B.复合材料的主要优点有:强度高、耐高温、耐腐蚀性,同时又具有质量轻的优点;
C.相对分子质量超过10000,为高分子化合物;
D.以煤、石油和天然气为主要原料可制造合成纤维等.
解答 解:A.纳米材料是指材料的粒度以纳米计,故A错误;
B.复合材料的性能超过单一材料,故B正确;
C.淀粉和纤维素通式都是(C6H10O5)n,二者在自然界中都存在,所以都是天然高分子化合物,故C正确;
D.以煤、石油和天然气为主要原料可制造化工产品、合成塑料、合成橡胶、合成纤维等,故D正确;
故选:A.
点评 本题考查了常见生活常识,涉及光导纤维、纳米材料、合成纤维等知识点,明确物质的性质、构成及对环境的影响即可解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
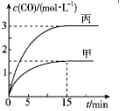 一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、 1mol H2O(g) | 1mol CO、 1mol H2 | 4mol C、 2mol H2O(g) |
| A. | 丙容器的容积V<0.5L | |
| B. | 甲容器中,反应在前15 min内的平均反应速率v(H2)=0.15 mol•L-1•min-1 | |
| C. | 当温度为T1℃时,反应的平衡常数K=2.25 | |
| D. | 乙容器中,若平衡时n(H2O)=0.3 mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源 | |
| B. | 白铁(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应采取深度填埋法 | |
| D. | 测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2在反应中作氧化剂 | B. | 该反应转移了4e- | ||
| C. | Hg是被还原得到的产物 | D. | HgS既是还原剂又是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4所含的原子数为0.5 NA | |
| B. | 100 m L 0.1 mol/L的 NaCl 溶液中,所含微粒总数为0.02 NA | |
| C. | 1.7 g 的OH-中含有的电子数为NA | |
| D. | 78 g Na2O2 与足量水反应转移电子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、Cl-、HCO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | Cl-、NH4+、Ag+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com