

分析 (1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;
(2)由于锌片和铜片都有铜析出,需要利用差量法进行计算反应消耗的锌的质量,再根据铜片质量增加的物质的量计算出参加原电池反应的锌的物质的量,最后计算出原电池工作效率;根据原电池工作中电流方向判断,钾离子与电流方向一致;根据电荷守恒判断钾离子流到速率;
(3)原电池中阳离子移向正极;依据总反应方程式和负极电极反应计算得到正极电极反应式.
解答 解:(1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;①组装置中铁电极腐蚀最快;正极反应是氧气得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-;②③装置中铁被保护,③为外加电流阴极保护,效果最好,故答案为:①;O2+4e-+2H2O=4OH-;③;外加电流阴极保护法;
(2)铜片、锌片表面均有红色物质铜析出,理解减小的质量为:3.94g-3.84g=0.1g,
根据反应关系式:Zn~Cu△m(减小)
65 64 1
6.5g 0.1g
参加反应的锌的质量为6.5g,
根据电子守恒,参加原电池反应的锌的物质的量为n(Zn)=n(Cu)=$\frac{3.84g}{64g/mol}$=0.06mol,该原电池的工作效率为:$\frac{0.06mol×65g/mol}{6.5g}$×100%=60%
铜为正极,锌为负极,电流在外电路有铜流向锌,溶液中电流由锌流向铜,所以钾离子流向硫酸铜溶液,氯离子流向硫酸锌溶液;根据电荷守恒可知,如果Zn的消耗速率为1×10-3mol/s,则钾离子则K+的迁移速率为2×10-3
故答案为:60%;2×10-3;
(3)FePO4+Li$?_{充电}^{放电}$LiFePO4 放电过程是原电池,总反应方程式减去负极反应得到正极电极反应:FePO4+Li++e-=LiFePO4;
故答案为:正;FePO4+Li++e-=LiFePO4.
点评 本题考查了金属腐蚀与防护的方法和应用,原电电解池电极反应书写应用,题目难度中等,书写电极反应式是解题的关键.


科目:高中化学 来源: 题型:填空题
 实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).
实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用).| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、 碱石灰、Cu、Zn、Na2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上有5个电子的X原子与原子核外N层上有5个电子的Y原子 | |
| C. | 2p轨道上有一个未成对电子的X原子与3p轨道上有一个未成对电子的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
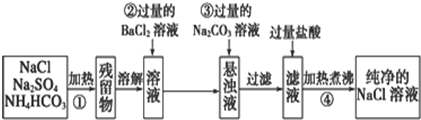
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
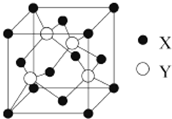 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
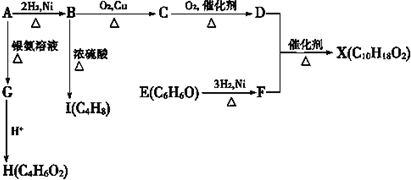
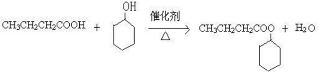 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
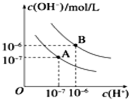 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com