
【题目】X、Y、Z、W、R 均是 1-18 号元素,原子序数依次增大。X 是所有元素中原子半径最小的元素,Y 原子最外层电子数是次外层电子数的 3 倍,Z、W、R 电子层数相同,R 与 Y 最外层电子数相同,Z、W 原子的核外电子数之和与 Y、R 原子的核外电子数之和相同。请回答下列问题:
(1)写出:W 的原子结构示意图_______,R 离子的电子式_________________。
(2)X、Y、Z 三种元素形成的化合物属于_______化合物(填“离子”或“共价”),其电子式为 _______。
(3)X 与 Y 元素可形成一种常用的消毒剂,其结构式为 _______。
(4)Y、Z、W、R 形成的简单离子半径由大到小顺序为_______。
(5)写出由 X、Y、Z、R 四种元素形成的化合物的电离方程式_______。
【答案】
![]() 离子
离子 ![]() H-O-O-H S2->O2->Na+>Al3+ NaHSO4=Na++H++SO42-
H-O-O-H S2->O2->Na+>Al3+ NaHSO4=Na++H++SO42-
【解析】
X、Y、Z、W、R 均是 1-18 号元素,原子序数依次增大。X 是所有元素中原子半径最小的元素,则X为氢(H);Y 原子最外层电子数是次外层电子数的 3 倍,则Y为氧(O);Z、W、R 电子层数相同,则三者同周期;R 与 Y 最外层电子数相同,则R为硫(S);Z、W 原子的核外电子数之和与 Y、R 原子的核外电子数之和相同,则Z、W 原子的核外电子数之和为24,所以Z的核外电子数必定小于12,只能为钠(Na),从而得出W为铝(Al)。
(1)由以上推断可知,W为铝,则其原子结构示意图为 ,R为硫,则其离子的电子式为
,R为硫,则其离子的电子式为![]() 。答案为:
。答案为: ;
;![]() ;
;
(2)X、Y、Z 三种元素形成的化合物是NaOH,属于离子化合物,其电子式为![]() 。答案为:离子;
。答案为:离子;![]() ;
;
(3)X 与 Y 元素可形成一种常用的消毒剂,其化学式为H2O2,结构式为H-O-O-H。答案为:H-O-O-H;
(4)Y、Z、W、R 形成的简单离子,S2-核外有3个电子层,半径最大,O2-、Na+、Al3+电子层数相同,核电荷数越大,离子半径越小,则O2->Na+>Al3+,从而得出四者半径由大到小顺序为S2->O2->Na+>Al3+。答案为:S2->O2->Na+>Al3+;
(5)由 X、Y、Z、R 四种元素形成的化合物为NaHSO4,它是强酸的酸式盐,在水溶液中完全电离,电离方程式为NaHSO4=Na++H++SO42-。答案为:NaHSO4=Na++H++SO42-。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1。
(1)Z的最外层电子轨道排布图为__;W元素的名称为__。
(2)XY2分子中X原子的杂化轨道类型为__;XO32-的空间构型为__。
(3)第一电离能X__Z(填“>”、“<”或“=”,下同);氢化物稳定性X__Y。
(4)配位化合物是中心金属原子或离子提供空轨道,配体提供孤电子对,以配位键结合而形成的一类化合物,中心原子或离子接受的鬼电子对数,称为配位数,则配位化合物[W(NH3)4(H2O)2]Cl2中,中心W2+的配位数为__;其结构中不含有的作用力有___。
A.极性键 B.非极性键 C.配位键 D.离子键
(5)金属Z的单质的晶胞结构如图:
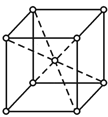
①区别晶体和非晶体的最科学的方法是__。
②上述金属晶体原子堆积模型为__型,其原子的空间利用率为__。
③若Z的摩尔质量为Mg/mol,密度为ρg/cm3,则Z的原子半径为___cm(列出算式即可)。
(6)已知:晶格能越大,离子晶体越稳定.则CaO、MgO、NaCl的稳定性由大到小的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小。向10mL 0.3 mol·L-1Ba(OH)2溶液滴入0.3 mol·L-1 NH4HSO4溶液,其电导率随滴入的NH4HSO4溶液体积的变化如图所示(忽略BaSO4溶解产生的离子)。下列说法不正确的是
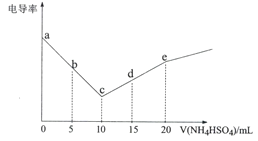
A.a→e的过程水的电离程度逐渐增大
B.b点:c(Ba2+) =0.1 moI.L-1
C.c点:c(NH4+)<c(OH-)
D.d点:c(SO42-)+c(H+)>c(OH-)+c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上绝大部分卤素都存在于海洋。海水晒盐可以得到粗盐和卤水,对粗盐和卤水进一步加工可以得到氯气、溴以及其他一些重要的化工产品。完成下列填空:
(1)工业上用电解饱和食盐水的方法获取氯气。写出电解饱和食盐水的离子方程式_______。若转移 5mol 电子,生成氯气_______L(标准状况下)。
溴主要以 Br-形式存在于海水中,海水呈弱碱性。工业上制备的 Br2 的操作步骤为:
①一定条件下,将 Cl2 通入浓缩的海水中,生成 Br2
②利用热空气将 Br2 吹出,并用浓 Na2CO3 溶液吸收,生成 NaBr、NaBrO3、CO2
③用硫酸酸化步骤②得到的混合物
(2)先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是 _______。
(3)写出步骤②化学方程式 _______。
(4)写出步骤③所发生的化学反应方程式并标出电子转移的方向和数目_______。
(5)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)![]() x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
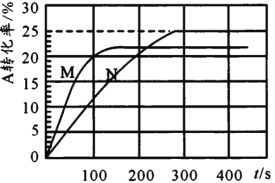
A.x可能为4
B.M为容器甲
C.容器乙达平衡时B的转化率为25%
D.M的平衡常数大于N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质投入溶液中,溶液质量减轻的是( )
A.CaCO3投入到HCl溶液中
B.Na2CO3投入稀硫酸中
C.Fe粉投入CuSO4溶液中
D.Fe粉投入稀HCl溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫在生产和生活中有着广泛的用途。
(1)SO2可用来制备定影剂Na2S2O3,,反应的化学方程式为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2↑。请用单线桥表示该反应中的电子转移情况______,还原剂与氧化剂的物质的量之比为____。
(2)用足量NaOH溶液吸收尾气中的SO2,反应的离子方程式为______;吸收后的浓溶液可用图1的装置再生循环脱硫,并制得硫酸,电极a的电极反应为_____,乙是____。
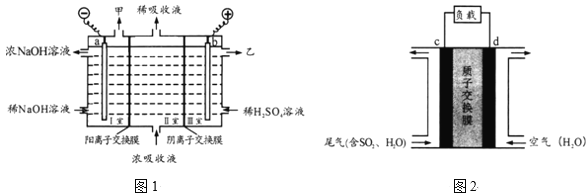
(3)可设计二氧化硫空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图2所示。其能量转化的主要形式是______,c电极是__极,移动的离子及方向是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物数量众多,分布极广,与人类关系非常密切。
(1)石油裂解得到某烃A,其球棍模型为![]() ,它是重要的化工基本原料。
,它是重要的化工基本原料。
①A的结构简式为_________,A的名称是____________。
②A与溴的四氯化碳溶液反应的化学方程式为_______________。

③A→C的反应类型是____,C+D→E的化学方程式为_______,鉴别C和D的方法是_______。
④A的同系物B的相对分子质量比A大14,B的结构有____种。
(2)生苹果肉遇碘酒变蓝,熟苹果汁能与银氨溶液反应,苹果由生到成熟时发生的相关反应方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列说法正确的是( )
A.给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜
B.![]() 通入足量的
通入足量的![]() 稀溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:
稀溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:![]() 稀硫酸
稀硫酸![]()
C.配制一定物质的量浓度溶液时发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥
D.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com