
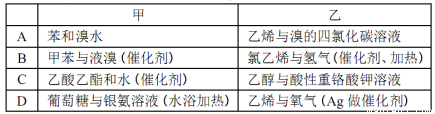
下列各组物质能够发生化学反应,且甲为取代反应、乙为加成反应的一组是
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列过程中,共价键被破坏的是
A.碘升华B.溴蒸气被木炭吸附C.蔗糖溶于水D.氯化氢气体溶于水
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:填空题
(10分)某同学设计了如图所示的装置(夹持装置已略去)来探究影响化学反应速率的因素。
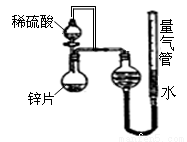
(1)圆底烧瓶中发生反应的离子方程式是
__________________________________________
(2)用上述装置进行实验,以生成15.0mL气体为计时终点,
结果为t1﹥t2
序号 | Ⅴ(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
Ⅰ | 10 | 1 | t1 |
Ⅱ | 10 | 3 | t2 |
比较实验Ⅰ和实验Ⅱ可以得出的结论是__________________________________________
(3)实验中向烧瓶中滴入的稀硫酸的体积(其他操作都正确),对测定气体体积的影响_____ __________ (填“偏大”、“偏小”、“无影响”)
(4)将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含的杂质可能是(填序号)________
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(5)要加快该反应的反应速率,还可以采取的措施有________________________(任填一种即可)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
下列有关化学用语使用正确的是
A.的结构示意图 B.中子数为20的氯原子:37 17Cl
B.中子数为20的氯原子:37 17Cl
C.明矾的化学式: KAlSO4·12H2O D.CO2的电子式: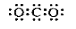
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:简答题
(13分)某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:填空题
(12分).
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为_______________。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为_______。平衡时A 的转化率为_____.
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=_______mol,n(A)=_______mol。
②下表为反应物A浓度与反应时间的数据,计算a= _______________
反应时间t/h | 0 | 4 | 8 | 16 |
C(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
分析该反应中反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是_________________,由此规律推出反应在12h时反应物的浓度c(A)为_______mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A.这四种离子的电子层结构相同,因而离子的性质也就相同
B.原子序数:b>a>c>d
C.最高价氧化物对应水化物的碱性:B>A
D.气态氢化物的稳定性:D>C
查看答案和解析>>
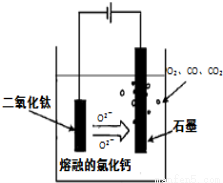
科目:高中化学 来源:2013-2014湖北省宜昌市高三5月模拟理综化学试卷(解析版) 题型:实验题
(14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
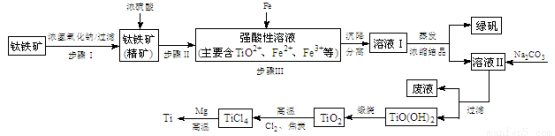
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,

TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因 是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| TiCl4 | Mg | MgCl2 | Ti |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(4)电解TiO2制备钛的方法如图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:选择题
质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是燃料电池的一种。如图是质子交换膜氢氧燃料电池,下列有关该电池的原理的描述正确的是
A.溶液中H+透过质子交换膜从右向左迁移
B.b极发生氧化反应
C.电子从a极流出经溶液流到b极
D.该电池在使用过程中,H+的物质的量保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com