
【题目】在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是( )
2SO3(g) ΔH<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ,则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器容积为2L,则v(SO3)=0.35mol·L-1·min-1
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)>1.4mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量小于QkJ
【答案】D
【解析】A、根据反应在恒温恒压条件下进行分析;B、根据化学反应速率的概念分析计算;C、绝热条件温度升高平衡逆向进行;D、恒温恒容条件反应过程中,压强减小。
详解:A、反应在恒温恒压条件下进行,应前后的压强之比为1:1,故A错误;
B、若容器体积不变, v(SO3)=![]() =0.35mol·L-1·min-1,但反应是在恒温恒压条件进行,反应达到平衡时,容器体积小于2L,相等于增大体系压强,化学反应速率增大,所以v(SO3)>0.35mol·L-1·min-1,故B错误;
=0.35mol·L-1·min-1,但反应是在恒温恒压条件进行,反应达到平衡时,容器体积小于2L,相等于增大体系压强,化学反应速率增大,所以v(SO3)>0.35mol·L-1·min-1,故B错误;
C、若把“恒温恒压下”改为“恒压绝热条件下”反应,由于该反应的正反应是放热反应,绝热温度升高,平衡逆向进行,平衡后n(SO3)<1.4mol,所以C选项是错误的;
D、若把“恒温恒压下”改为“恒温恒容下”反应,反应过程中压强减小,平衡逆向进行,达平衡时放出热量小于QkJ,故D正确。
所以D选项是正确的。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
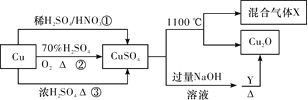
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B. 相对于途径①、③,途径②更好地体现了绿色化学思想
C. 1 mol CuSO4在1100 ℃所得混合气体X中O2为0.75 mol
D. Y可以是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温、同压下,已知下列各反应为放热反应,下列各热化学方程式中反应热最小的是
A.H2(l)+F2(l)===2HF(g) ΔH1
B.H2(g)+F2(g)===2HF(g) ΔH2
C.H2(g)+F2(g)===2HF(l) ΔH3
D.H2(l)+F2(l)===2HF(l) ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 无色溶液中:Na+、NH4+、Cu2+、SO42-
B. ![]() =1×10-12 的溶液中:K+、Na+、CO32-、NO3-
=1×10-12 的溶液中:K+、Na+、CO32-、NO3-
C. 与铝反应产生大量氢气的溶液:Na+、NH4+、HCO3-、Cl-、
D. 酸性溶液中:Na+、ClO-、I-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池、电解池的电极名称,下列说法错误的是
A. 原电池中失去电子的一极为负极
B. 电解池中与直流电源负极相连的一极为阴极
C. 原电池中相对活泼的一极为正极
D. 电解池中发生氧化反应的一极为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 标准状况下,22.4LCHCl3含有的分子数目为NA
B. 3.4g羟基(-OH)含有2NA个电子
C. 1L0.1mol/L甘氨酸( )溶液中含有的氧原子数为0.2NA
)溶液中含有的氧原子数为0.2NA
D. 0.5molC4H10中含有的非极性共价键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列4种方法:①焦炭法;②水煤气法(或氢气、或一氧化碳)法;③活泼金属置换法;④电解法。4种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析不正确的是
A. (Ⅰ)用① B. (Ⅱ)用② C. (Ⅲ)用③ D. (Ⅳ)用④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com