
| 试剂 | 离子反应方程式 | |
| ①Mg(Al) | ||
| ②FeCl2溶液(FeCl3) | ||
| ③NaHCO3(Na2CO3) |
分析 ①Al与NaOH溶液反应,而Mg不能;
②Fe与氯化铁反应生成氯化亚铁;
③碳酸钠、水、二氧化碳反应生成碳酸氢钠.
解答 解:①Al与NaOH溶液反应,而Mg不能,则试剂为氢氧化钠溶液,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑;
②Fe与氯化铁反应生成氯化亚铁,则试剂为铁粉,离子反应为2Fe3++Fe=3Fe2+;
③碳酸钠、水、二氧化碳反应生成碳酸氢钠,则试剂为CO2,离子反应为CO32-+CO2+H2O=2HCO3-,
故答案为:
| 试剂 | 离子反应方程式 | |
| ①Mg(Al) | 氢氧化钠溶液 | 2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| ②FeCl2溶液(FeCl3) | 铁粉 | 2Fe3++Fe=3Fe2+ |
| ③NaHCO3(Na2CO3) | CO2 | CO32-+CO2+H2O=2HCO3- |
点评 本题考查混合物分离提纯,为高考常见题型,侧重于学生的分析、实验能力的考查,把握物质的性质、混合物分离提纯、发生的反应为解答的关键,注意元素化合物知识的综合应用,题目难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
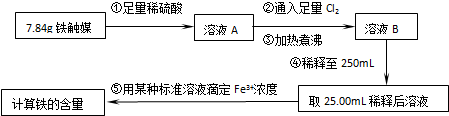
| 实验操作 | 实验现象与结论 |
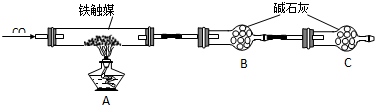
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | F | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 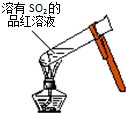 加热后溶液颜色变为无色 加热后溶液颜色变为无色 | |
| B. |  配制100 mL 0.10 mol•L-1NaCl溶液 配制100 mL 0.10 mol•L-1NaCl溶液 | |
| C. |  实验室用该装置制取少量蒸馏水 实验室用该装置制取少量蒸馏水 | |
| D. |  称量25 g NaOH 称量25 g NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫粉在过量的纯氧中燃烧可以生成三氧化硫 | |
| B. | 用饱和碳酸钠溶液除去二氧化碳中的二氧化硫 | |
| C. | 等质量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的量:Na2CO3<NaHCO3 | |
| D. | 过量的铁在氯气中燃烧生成FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量逐渐增大 | B. | 核外电子排布呈现周期性变化 | ||
| C. | 原子半径呈现周期性变化 | D. | 元素化合价呈现周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com