
 2SO3的平衡常数见下表。
2SO3的平衡常数见下表。| 温度(℃) | 527 | 758 | 927 |
| 平衡常数 | 784 | 1.0 | 0.04 |

 2MgO+CO2+SO2+SO3
2MgO+CO2+SO2+SO3  2MgO+CO2+SO2+SO3;② PtCl42-+SO2+H2O=SO42-+4H++4Cl-+Pt↓; ③由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,该电池反应的总反应方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2。
2MgO+CO2+SO2+SO3;② PtCl42-+SO2+H2O=SO42-+4H++4Cl-+Pt↓; ③由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,该电池反应的总反应方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
A.CH3OH(l)+ O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol |
| C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH="+1452" kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。 4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1; 5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1; 7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1; 2NO(g)的ΔH= kJ?mol-1。
2NO(g)的ΔH= kJ?mol-1。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
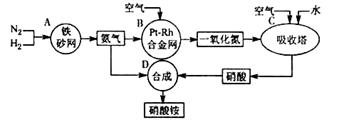
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol·L-1的 硝酸体积/mL | 硝酸铜 晶体/g | 亚硝酸钠 晶体/g | 实验目的 |
| ① | 5 | 20 | _______ | _______ | 实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
| ② | 5 | 20 | 0.5 | 0 | |
| ③ | 5 | 20 | 0 | 0.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.—(4Q—2M—N)KJ/mol | B.—(4Q—M—2N)KJ/mol |
| C.—(2Q—M—2N)KJ/mol | D.—(2Q—2M—N)KJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
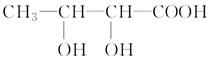
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。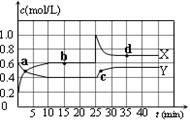
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com