
【题目】磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料。某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:

已知:2LiAl(SiO3)2+H2SO4(浓)![]() Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
温度/℃ | 20 | 40 | 60 | 80 | |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | |
溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中可分离出Al2O3,如图所示。请写出生成沉淀的离子方程式___。
![]()
(2)滤渣Ⅱ的主要成分是:___(填化学式)。
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是___。
(4)写出在高温下生成磷酸亚铁锂的化学方程式:___。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:___。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为___。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:___。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为___。
【答案】Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Mg(OH)2、CaCO3 Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失 2FePO4+Li2CO3+2C![]() 2LiFePO4+3CO↑ FePO4+Li++e-=LiFePO4 1.4g
2LiFePO4+3CO↑ FePO4+Li++e-=LiFePO4 1.4g
【解析】
锂辉石中加入浓硫酸,2LiAl(SiO3)2+H2SO4(浓)![]() Li2SO4+Al2O34SiO2H2O↓,Al2O34SiO2H2O沉淀出来,即滤渣I,滤液I中含有Li2SO4、MgSO4、CaSO4,向滤液中加入NaOH、Na2CO3,镁离子和NaOH反应生成氢氧化镁沉淀,钙离子和碳酸钠反应生成碳酸钙沉淀,所以滤渣II为Mg(OH)2、CaCO3,滤液II中含有硫酸锂,向滤液中加入饱和碳酸钠得到碳酸锂沉淀;铁红和磷酸反应生成磷酸铁,C、磷酸铁和碳酸锂在高温下反应生成LiFePO4,据此分析解答。
Li2SO4+Al2O34SiO2H2O↓,Al2O34SiO2H2O沉淀出来,即滤渣I,滤液I中含有Li2SO4、MgSO4、CaSO4,向滤液中加入NaOH、Na2CO3,镁离子和NaOH反应生成氢氧化镁沉淀,钙离子和碳酸钠反应生成碳酸钙沉淀,所以滤渣II为Mg(OH)2、CaCO3,滤液II中含有硫酸锂,向滤液中加入饱和碳酸钠得到碳酸锂沉淀;铁红和磷酸反应生成磷酸铁,C、磷酸铁和碳酸锂在高温下反应生成LiFePO4,据此分析解答。
(1)滤渣I的主要成分为Al2O34SiO2H2O,将滤渣Ⅰ溶于酸得到铝离子,氢氧化铝不溶于弱碱但能溶于强碱,所以过量的试剂为氨水,向溶液中加入氨水得到Al(OH)3沉淀,灼烧Al(OH)3沉淀得到Al2O3,所以生成沉淀的反应为铝离子与氨水的反应,反应的离子反应方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(2)滤液I中存在Ca2+、Mg2+离子,经过调解pH值后,Ca2+、Mg2+沉淀分别得到氢氧化镁和碳酸钙,所以滤渣Ⅱ的主要成分是Mg(OH)2、CaCO3,故答案为:Mg(OH)2、CaCO3;
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”;根据表格数据可知,碳酸锂的溶解度随温度升高而减小,用“热水洗涤”,可以减少沉淀的损失,故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(4)依据图示可知反应物为FePO4、Li2CO3和C,产物为CO和LiFePO4,此反应为氧化还原反应,Fe、和C元素的化合价发生变化,反应的化学方程式为:2FePO4+Li2CO3+2C![]() 2LiFePO4+3CO↑,故答案为:2FePO4+Li2CO3+2C
2LiFePO4+3CO↑,故答案为:2FePO4+Li2CO3+2C![]() 2LiFePO4+3CO↑;
2LiFePO4+3CO↑;
(5)FePO4+Li![]() LiFePO4,电池放电时是原电池原理,Li失电子发生氧化反应做原电池负极,FePO4在正极得到电子发生还原反应生成LiFePO4,电极反应为:FePO4+Li++e-=LiFePO4;
LiFePO4,电池放电时是原电池原理,Li失电子发生氧化反应做原电池负极,FePO4在正极得到电子发生还原反应生成LiFePO4,电极反应为:FePO4+Li++e-=LiFePO4;
若用该电池用惰性电极电解饱和食盐水,当电解池两极共有4480mL气体(标准状况)产生时,两极产生的气体的物质的量为0.2mol,根据2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,生成氢气的物质的量0.1mol,依据H2~2Li~2e-可知,消耗锂的质量=0.2mol×7g/mol=1.4g,故答案为:FePO4+Li++e-=LiFePO4;1.4g。
2NaOH+H2↑+Cl2↑,生成氢气的物质的量0.1mol,依据H2~2Li~2e-可知,消耗锂的质量=0.2mol×7g/mol=1.4g,故答案为:FePO4+Li++e-=LiFePO4;1.4g。


科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 有机物![]() 属于芳香烃,含有两种官能团
属于芳香烃,含有两种官能团
B. 按系统命名法,化合物![]() 的名称为2,4,6-三甲基-5-乙基庚烷
的名称为2,4,6-三甲基-5-乙基庚烷
C. 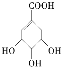 既属于醇类又属于羧酸
既属于醇类又属于羧酸
D. 2-甲基-3-丁烯的命名错误原因是选错了主链
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是同学们熟悉的物质:
①O2②H2O2③MgCl2④H2SO4⑤Na2CO3⑥NH4Cl⑦CO2⑧Ne⑨Na2O2⑩NaOH
(1)这些物质中,属于共价化合物的是________(填序号,下同);只含有离子键的是________;不含化学键的是________。
(2)写出下列物质的结构式:
①O2________;②H2O2_______。
(3)写出下列物质的电子式
⑨Na2O2__________;⑦CO2__________;⑥NH4Cl____________。
(4)用电子式表示③MgCl2的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的4位科学家,其研究对象之一为“分子开关”,即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图I所示)可用于ⅢB族元素对应的离子萃取,如La2+、Sc2+。写出基态二价钪离子的核外电子排布式____。
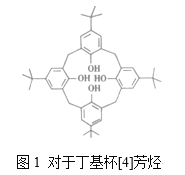
(2)对于叔丁基杯[4]芳烃由4个羟基构成杯底,羟基中氧原子的杂化方式为____,羟基间的相互作用力为_____。
(3)已知C60分子结构和C60晶胞示意图如图所示:
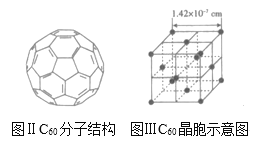
则1个C60分子中含有的![]() 键个数为_____,与1个C60分子距离最近且相等的C60分子有_____个,C60晶体的密度为_____gcm3(写出表达式)。
键个数为_____,与1个C60分子距离最近且相等的C60分子有_____个,C60晶体的密度为_____gcm3(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,不能用于实验室制取氨的是
A. 加热试管中的氯化铵固体
B. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
C. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
D. 将烧瓶中的浓氨水加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1mol·L-1的溶液,溶解过程如图所示,下列说法正确的是
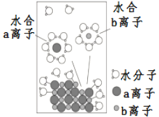
A.b的离子为Cl-
B.溶液中含有NA个Na+
C.水合b离子的图示不科学
D.40℃时该溶液的pH小于7,是由于Na+水解所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)药物安全是国家高度重视的民生问题,化学在新型药物的研究中贡献巨大。根据题意,用下列选项的字母代号填空。
A.阿司匹林(乙酸水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①治疗胃酸过多,但患有严重的胃溃疡,应该选择_______;
②可治疗支气管哮喘,但不宜过多服用(导致兴奋)的药物的是_______;
③是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是_______;
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是_______。
(2)2017年11月23日,国产大型喷气式客机C919首架机在航空工业试飞中心完成转场陕西阎良后的首次试飞,标志着C919向取得适航证并最终投入航线运营迈出关键一步。
①机身蒙皮使用的是第三代铝锂合金材料。下列不属于铝锂合金性质的是_______ (填字母)。

A.密度大 B.硬度大 C.抗腐蚀
②飞机轮胎属于橡胶制品。下列材料可用来合成橡胶的是_______ (填字母)。
A.石英砂 B.异戊二烯 C.石灰石
③机体先进复合材料的使用率达12%。下列属于复合材料的是_______ (填字母)。
A.钛合金 B.普通陶瓷 C.玻璃钢
(3)良好的生态环境和科学的饮食可以提升生活质量,根据题意,用下列选项的字母代号填空。
①臭氧层的破坏导致紫外线对地球表面辐射的增加,从而使全球皮肤癌的发病率明显增加。造成这一现象的主要原因是_______;
A.大量使用氟氯烃
B.炼钢时排放了大量高炉煤气
C.石油炼制厂排放了大量的甲烷、氢气
D.硝酸、硫酸工厂排放了大量的二氧化硫和一氧化氮
② 下列说法正确的是_______;
A.为使火腿肠颜色更鲜红,应多加一些亚稍酸钠
B.为摄取足够的蛋白质,应多吃肉、少吃豆制品
C.为减少室内甲醛污染,应提倡居室简单装修
D.为增强婴儿的食欲,应在婴儿食品中多加着色剂
③ 水体污染加剧了水资源的短缺。处理含Hg2+等重金属离子的废水常用的方法是_________;
A.沉淀法 B.中和法 C.蒸馏法 D.混凝法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
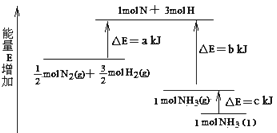
A.N2(g)+3H2(g)=2NH3(l) △H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)=2NH3(g) △H=2(b-a)kJ/mol
C.1/2 N2(g)+3/2H2(g)=NH3(l) △H=(b+c-a)kJ/mol
D.1/2 N2(g)+3/2H2(g)=NH3(g) △H=(a+b)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com