
【题目】反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在 5L密闭容器中进行,30秒后,NO的物质的量增加了0.3mol,则此反应的平均速率v(x)(表示反应物的消耗速率或生成物的生成速率)为( )
A.v (O2)=0.0l molL﹣1s﹣1
B.v (NO)=0.002 molL﹣1s﹣1
C.v (H2O)=0.003 molL﹣1s﹣1
D.v(NH3)=0.001 molL﹣1s﹣1
【答案】BC
【解析】解:5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则v(NO)= ![]() =0.002mol/(L.s),
=0.002mol/(L.s),
A.V(O2)= ![]() v(NO)=0.002mol/(L.s)×
v(NO)=0.002mol/(L.s)× ![]() =0.0025mol/(L.s),故A错误;
=0.0025mol/(L.s),故A错误;
B.由上述计算可知,v(NO)=0.002mol/(L.s),故B正确;
C.V(H2O)= ![]() v(NO)=0.002mol/(L.s)×
v(NO)=0.002mol/(L.s)× ![]() =0.003mol/(L.s),故C正确;
=0.003mol/(L.s),故C正确;
D.V(NH3)=v(NO)=0.002mol/(L.s),故D错误;
故选BC.
【考点精析】认真审题,首先需要了解反应速率的定量表示方法(反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t).


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.200 0 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2 (g) +3H2 (g) ![]() CH3OH(g)十H2O (g);ΔH= -25kJ·mol-1。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析不正确的是( )
CH3OH(g)十H2O (g);ΔH= -25kJ·mol-1。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析不正确的是( )
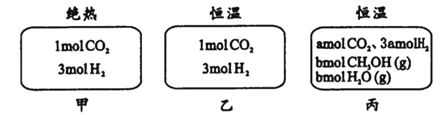
A. 刚开始反应时速率:甲=乙 B. 平衡后反应放热:甲<乙
C. 若a≠0,则0.9<b<l D. 500℃下该反应平衡常数K =3×102
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 单体的质量之和等于所生成的高分子化合物的质量
B. 单体为一种物质时,则单体发生加聚反应
C. 缩聚反应的单体至少有两种物质
D. 淀粉和纤维素的聚合度不同,不互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)![]() (绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是________________________;
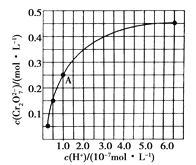
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如上图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应_____________________;
②由图可知,溶液酸性增大,CrO42-的平衡转化率________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________;
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH________0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示滴定终点的到达。当溶液中Cl-恰好沉淀完全(Cl-浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为________mol·L-1,此时溶液中c(CrO![]() )等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
)等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的描述不正确的是( )
A.刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3 B.硅可用于制作太阳能电池
C.Fe2O3俗称磁性氧化铁,可用作指南针 D.NaHCO3可用于作发酵剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.4g Al投入200.0mL 2.0mol/L 的溶液中有氢气产生,成充分反应后有金属剩余。该溶液可能为
A. HNO3溶液 B. Ba(OH)2溶液 C. HCl溶液 D. H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
2NH3(g) ΔH=-92.4 kJ·mol-1。在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是______。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量______,密度______。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将______ (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将______ (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度______ (填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com