
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)①反应符合“原子经济”,说明该反应中反应物都完全转化为生成物;
②升高温度平衡向吸热方向移动,根据化学平衡常数与温度关系确定反应热;
③达到平衡时n(CO)=0.2mol/L×1L=0.2mol,则参加反应的n(CO)=(1-0.2)mol=0.8mol,CO转化率=$\frac{参加反应的n(CO)}{反应初始n(CO)}$×100%;先计算平衡时各物质浓度,再计算化学平衡常数,从而确定温度;
(2)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1 275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H3=-44.0kJ•mol-1
将方程式$\frac{1}{2}$×(①-②+③×4)得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),焓变进行相应的改变.
解答 解:(1)①反应符合“原子经济”,说明该反应中反应物都完全转化为生成物,根据生成物种类知,I符合原子经济,故答案为:I;
②升高温度平衡向吸热方向移动,根据表中数据知,升高温度化学平衡常数减小,说明平衡逆向移动,则正反应是放热反应,△H<0,故答案为:<;
③达到平衡时n(CO)=0.2mol/L×1L=0.2mol,则参加反应的n(CO)=(1-0.2)mol=0.8mol,CO转化率=$\frac{参加反应的n(CO)}{反应初始n(CO)}$×100%=$\frac{0.8mol}{1mol}$×100%=80%;
CO(g)+2H2(g)??CH3OH(g)
开始(mol/L)1 3 0
反应(mol/L)0.8 1.6 0.8
平衡(mol/L)0.2 1.4 0.8
化学平衡常数K=$\frac{0.8}{1.{4}^{2}×0.2}$=2.041,所以该反应温度为250℃,
故答案为:80%;250℃;
(2)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
根据盖斯定律,将已知反应$\frac{1}{2}$×(①-②+③×4)得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=$\frac{1}{2}$×[(-1275.6kJ/mol)-(-566.0kJ/mol)+(-44.0kJ/mol)×4]=-442.8kJ•mol-1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
点评 本题考查化学平衡计算及盖斯定律,为高频考点,侧重考查学生分析计算能力,注意:计算化学平衡常数K时必须用平衡时浓度计算,题目难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②>③>①>④ | B. | ②>③>④>① | C. | ①>④>②>③ | D. | ①>③>④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:
空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
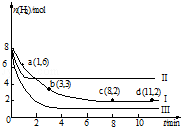 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )| A. | 该反应在0~8 min内CO2的平均反应速率是 0.375 mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20% | |
| C. | 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行 | |
| D. | 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/% | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2s的平均速率v(CO)=0.080mol/L/s | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.11mol/L | |
| C. | T K时起始向容器中充入0.9molCOCl2/0.10molCO,反应达到平衡前v(正)>v(逆) | |
| D. | T K时起始向容器中充入1.0molCl2和0.9molCO.达到平衡时,Cl2的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 变化过程 | △H | △S |
| 4Fe(s)+3O2(g)=2Fe2O3(s) | <0 | |
| CaCO3(s)分解为CaO(s)和CO2(g) |
| 时间/min | A | B | C | D |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com