
【题目】羰基硫(COS)能引起催化剂中毒,使化学产品质量下降并引发大气污染,因此工业排放COS前必须对其进行脱硫处理,发生的反应如下:COS(g)+H2(g)![]() H2S(g)+CO(g) 。.
H2S(g)+CO(g) 。.
(1)在480 K 时,将0.l0mol COS(g) 与0.40mol H2(g)充入2.5 L 的空钢瓶中,反应达到平衡后H2S 的物质的量分数为2%。
①COS的平衡转化率a1=_________ %。
②在500 K 时重复实验,测得平衡后H2S的物质的量分数为3%,则COS的转化率a2____________(填“>”“<”或“=”,下同)a1,该反应的△H________0。
(2)若分别向钢瓶中再充入下列气体,能使COS转化率增大的是___________(填字母)。
A.COS B.H2 C.H2S D.N2
【答案】 10 > > B
【解析】本题考查化学平衡的计算、影响化学平衡移动的因素,(1)①
COS(g)+H2(g)![]() H2S(g)+CO(g)
H2S(g)+CO(g)
起始: 0.1 0.4 0 0
变化: x x x x
平衡: 0.1-x 0.4-x x x H2S的物质的量分数为x/0.5×100%=2%,解得x=0.01mol,则COS的转化率为0.01/0.1×100%=10%;②500K时,H2S的物质的量分数为3%>2%,说明升高温度,平衡向正反应方向移动,因此有a2>a1,根据勒夏特列原理,正反应方向是吸热反应,即△H>0;(2)A、通入COS,虽然平衡向正反应方向移动,但COS的转化率降低,故A错误;B、通入氢气,平衡向正反应方向移动,COS的转化率增大,故B正确;C、通入H2S,生成物浓度增大,反应向逆反应方向移动,COS的转化率降低,故C错误;D、恒容状态下,充入非反应气体,组分的浓度不变,平衡不移动,COS的转化率不变,故D错误。


科目:高中化学 来源: 题型:
【题目】NH4Cl溶于重水(D2O)后,产生的一水合氨和水合氢离子均正确的是( )
A. NH2D·H2O和D3O+ B. NH3·D2O和HD2O+
C. NH3·HDO和D3O+ D. NH2D·HDO和H2DO+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
A.HCl和HIO B.HI和HClO C.HClO3和HIO D.HClO和HIO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KC1O3,且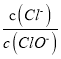 与温度高低有关。当n(KOH)=amol 时,下列有关说法错误的是
与温度高低有关。当n(KOH)=amol 时,下列有关说法错误的是
A. 若某温度下,反应后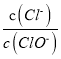 =11,则溶液中
=11,则溶液中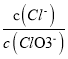 =
=![]()
B. 参加反应的氯气的物质的量等于![]() amol
amol
C. 改变温度,产物中KC1O3的最大理论产量为![]() amol
amol
D. 改变温度,反应中转移电子的物质的量n的范围: ![]() amol≤n≤
amol≤n≤![]() amol
amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种化合物都只含有X、Y两种元素,甲、乙中X元素的质量分数分别为30.4和25.9%,若已知甲的分子式是XY2,则乙的分子式只可能是( )
A.XY B.X2Y C.X2Y3 D.X2Y5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A 和B。A 为铵盐,B 在标准状况下为气态。在此反应中,若每有1体积氨气参加反应,同时有0.75 体积氟气参加反应;若每有8.96L 氨气(标准状况)参加反应,同时生成0.3 mol A。
(1) 写出氨气和氟气反应的化学方程式___________。
(2) 在标准状况下,每生成2.24LB,转移电子的物质的量为______mol。
Ⅱ.某固体可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现取该固体进行如下实验,所得现象和有关数据如下所示(气体体积的数据均已折算成标准状况下):

请回答下列问题:
(3)混合物中存在的物质有________(填化学式)。
(4)依照反应顺序写出步骤④的离子方程式:_________,___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中物质 | b中物质 | c中收集气体 | d中物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | 浓盐酸 | HCl | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E为原子序数依次增大的短周期元素,已知A,B,E3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3.
(1)写出下列元素名称:A , C;
(2)比较C,D的最高价氧化物的水化物,酸性较强的是(用化学式表示).
(3)由D,E两种元素形成的化合物,其中所有原子均达到稳定结构,写出该化合物的电子式 .
(4)写出A,B两元素最高价氧化物的水化物相互反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com