
北京2008奥运会金牌直径为70mm,厚6mm.某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)制成.为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误( )
A.硫酸铜溶液, B.盐酸, C.稀硝酸, D.硝酸银溶液
科目:高中化学 来源: 题型:
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。如图所示为它们的结构简式。下列关于这两种有机化合物的说法中正确的是( )
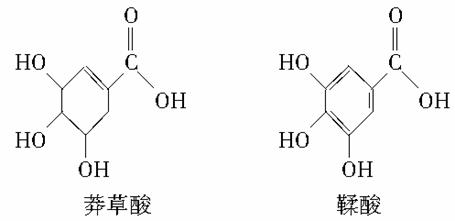
A.两种酸都能与溴水反应
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量金属钠反应产生氢气的量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C(石墨,s)===C(金刚石,s)(吸热反应),P4(白磷,s)===4P(红磷,s)(放热反应),下列判断正确的是( )
A.说明金刚石的内能比石墨低
B.说明红磷比白磷稳定
C.说明红磷比金刚石稳定
D.此种变化为物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关推断正确的是( )
A.SO3 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.酸酐一定是氧化物, 金属氧化物一定是碱性氧化物
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
一个体重50 kg的健康人含铁元素 2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+ 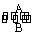 Fe3+。
Fe3+。
在过程A中,Fe2+作 剂。
维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有 性。
(2)某些补铁剂的成分是硫酸亚铁,长期放置会因氧化而变质。检验硫酸亚铁是否变质的试剂是______________(填序号)。
①稀盐酸 ②石蕊溶液 ③KSCN溶液
(3)要除去FeCl3溶液中少量的氯化亚铁,可行的办法是 (填字母)。
a.加入铜粉 b.加入铁粉 c.通入氯气 d.加入Na OH溶液
OH溶液
根据选用的试剂,写出该过程中发生反应的离子方程式 。
(4)电子工业常用30%的FeCl3 溶液腐蚀铜箔,制造印刷线路板,写出FeCl3 与金属铜反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,弱酸的电离平衡常数如表所示,下列离子反应方程式错误的是
| 弱酸 | H2SO3 | HClO | H2CO3 |
| Ka1 | 1.54×10-2 | 2.95×10-8 | 4.30×10-7 |
| Ka2 | 1.02×10-7 | 5.61×10-11 |
A.氯水中加入少量NaHCO3粉末:HCO3- + H+ = H2O+CO2↑
B.NaAl(OH)4溶液中通入足量的CO2:Al(OH)4-+CO2 =Al(OH)3↓+ HCO3-
C.NaClO溶液中通入少量CO2:2ClO- +H2O+CO2 = CO32- + 2HClO
D.Na2CO3溶液中通入少量SO2:2 CO32-+ H2O+ SO2 = SO32-+2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3-
B.稀HNO3溶液: Na+、Mg2+、SO42-、Cl-
C.FeCl3溶液:K+、Na+、I-、SO42-
D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是目前国际上公认的第四代高效、
无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1) ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与
还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
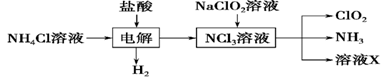
(2) 写出电解时发生反应的化学方程式:____________。
(3) 除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4) 测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,
再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O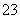 = 2I-+S4O
= 2I-+S4O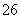 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
①装置中玻璃液封管的作用是_______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________。
③滴定终点的现象是________________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5) 用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO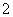 。
。
2001年我国卫生部规定,饮用水的ClO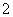 含量应不超过0.2 mg·L-1。若饮用水中ClO
含量应不超过0.2 mg·L-1。若饮用水中ClO 的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com