
| 1 |
| 2 |
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
| c 2(NH 3) |
| c(N 2)c 3(H 2) |
| c 2(NH 3) |
| c(N 2)c 3(H 2) |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
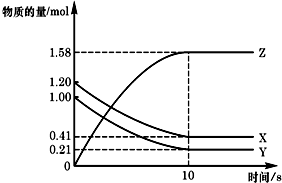 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A、应开始到10 s时,Y的转化率为79.0% |
| B、应的化学方程式为:X(g)+Y(g)=Z(g) |
| C、应开始到10 s,用Z表示的反应速率为0.158mol/(L?s) |
| D、开始到10 s,X的物质的量浓度减少了0.79mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
B、 通过观察如图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C、用润湿的pH试纸测定饱和Na2CO3溶液pH |
| D、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积,比较两种酸的电离程度:醋酸<盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成了一种强酸弱碱盐 |
| B、强酸溶液和弱碱溶液反应 |
| C、弱酸溶液和强碱溶液反应 |
| D、一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和②混合溶液中:c(H+)=3.0mol?L-1 |
| B、①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) |
| C、②和③混合溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) |
| D、四种溶液稀释100倍,溶液的pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:

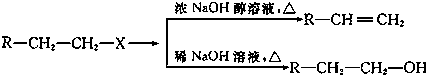
 合成
合成 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Si原子最外层有4个电子 | 单质及其氧化物硬度很大 |
| B | SO2具有漂白性 | SO2可使溴水褪色 |
| C | Na2O2能与CO2、H2O反应 | Na2O2用作呼吸面具的供氧剂 |
| D | 钠比铜活泼 | 钠可以与硫酸铜溶液反应置换出铜 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com