
 C(气)+2D(气),
C(气)+2D(气),| 3 |
| 2 |
| 3 |
| 2 |
| 0.5mol |
| 2L |
| 0.5mol |
| 2.5mol |
| 1.5mol+2mol+0.5mol+1mol |
| 3mol+2.5mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、气态氢化物的稳定性:X<Y |
| B、没有X元素也就没有丰富的有机世界 |
| C、非金属性Y>X,金属性W>Z |
| D、在一定条件下,利用X、Z或W单质的还原性,可以冶炼某些金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有0.9mol的硫酸参加反应 |
| B、有0.45mol的硫酸被还原 |
| C、充分反应后体系无硫酸剩余 |
| D、消耗的铜的质量一定少于28.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
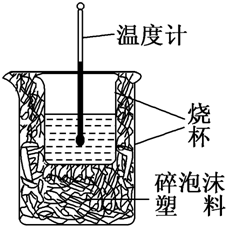 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com