
分析 蓝铜矿的主要成分为2CuCO3•Cu(OH)2,当它与焦炭一起加热时,可以生成铜、二氧化碳和水,Cu的化合价变化(+2→0),C的化合价变化(0→+4),根据得失电子守恒、原子守恒配平,有元素化合价变化的反应属于氧化还原反应.
解答 解:蓝铜矿的主要成分为2CuCO3•Cu(OH)2,当它与焦炭一起加热时,可以生成铜、二氧化碳和水,该反应中Cu的化合价变化(+2→0),C的化合价变化(0→+4),1mol2CuCO3•Cu(OH)2反应生成3molCu,得到6mol电子,所以最小公倍数为12,所以C前系数为4,2CuCO3•Cu(OH)2前系数为2,根据原子守恒可得,该反应的化学方程式为:2[2CuCO3•Cu(OH)2]+3C$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+7CO2↑+2H2O,有元素化合价变化的反应属于氧化还原反应,该反应属于氧化还原反应,
故答案为:2[2CuCO3•Cu(OH)2]+3C$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+7CO2↑+2H2O;氧化还原反应.
点评 本题考查方程式的书写,掌握氧化还原反应配平是解答关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 化学在能源开发与利用中起着十分重要的作用.
化学在能源开发与利用中起着十分重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二次电池在充电时,电池的负极要与外接电源的负极相连 | |
| B. | 用惰性电极电解硫酸铜溶液一段时间后,加入氢氧化铜可恢复原状 | |
| C. | 化学腐蚀是生活中最常见的一种金属腐蚀 | |
| D. | 燃料电池中的电极材料必须活性不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 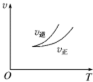 依据图可判断正反应为放热反应 | |
| B. | 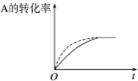 在图中,虚线可表示压缩反应装置体积的情况 | |
| C. | 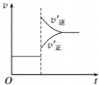 若正反应的△H>0,图可表示升高温度使平衡向逆反应方向移动 | |
| D. | 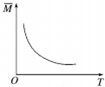 由图中混合气体的平均相对分子质量随温度的变化情况,可推知逆反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 4:1:3 | C. | 2:5:2 | D. | 2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2-甲基-2,4-己二烯
2-甲基-2,4-己二烯
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 己二酸
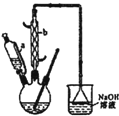
己二酸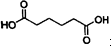 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下: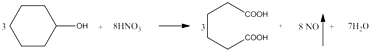
| 物质 | 密度(g/cm3) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.360/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 | 146 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18 g H2O含有的原子数为NA | |
| B. | 1.8 g的NH4+离子中含有的电子数为0.1 NA | |
| C. | 常温常压下,11.2 L氧气所含的原子数为NA | |
| D. | 2.4 g金属镁变为镁离子时失去的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com