
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、A13+、Ba2+、NH4+、CO32-、NO3ˉ、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。

根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有____________________。
(2)溶液X中关于硝酸根离子的判断,正确的是_______;(填编号,下同)
a. 一定含有 b. 一定不含有 c.可能含有
(3)气体F的电子式为__________,化合物I中含有的化学键类型有________;
(4)转化⑦的离子方程式为_________________________________________;
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是_________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
【答案】 CO32-、SiO32- b 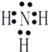 共价键和离子键 [Al(OH)4]ˉ+ CO2= HCO3ˉ+ Al(OH)3↓或AlO2ˉ+2H2O+ CO2= HCO3ˉ+ Al(OH)3↓ ②
共价键和离子键 [Al(OH)4]ˉ+ CO2= HCO3ˉ+ Al(OH)3↓或AlO2ˉ+2H2O+ CO2= HCO3ˉ+ Al(OH)3↓ ②
【解析】(1)在强酸性溶液中氢离子和碳酸根离子反应生成二氧化碳和水,硅酸根离子和氢离子反应生成硅酸沉淀,所以一定不会存在CO32-、SiO32-离子;
(2)加入过量硝酸钡生成沉淀,钡离子和硫酸根离子反应生成硫酸钡沉淀,说明一定含有SO42-,含有SO42-离子就一定不含Ba2+离子;气体A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+,则在酸性条件下一定不含NO3ˉ离子,否则酸性条件下NO3ˉ会将Fe2+氧化而不能大量共存,答案选b;(3)溶液B中加入过量NaOH溶液 并加热,生成气体F,则F为NH3,其电子式为:![]() ;溶液E为HNO3,气体F为NH3,E与F反应生成I为NH4NO3,含有的化学键类型有离子键和极性共价键;(4)根据题中提供的离子,前面已排除SiO32-的存在,则在过量氢氧化钠作用下得到的溶液H,通入过量二氧化碳后能产生沉淀K,K应该为氢氧化铝,则溶液H中含有偏铝酸根离子,故溶液X中含有A13+,转化⑦的离子方程式为[Al(OH)4]ˉ + CO2 = HCO3ˉ + Al(OH)3↓或AlO2ˉ+2H2O+ CO2 = HCO3ˉ + Al(OH)3↓;(5)综上可知,溶液中一定含有Fe2+、A13+、NH4+、NO3ˉ、SO42-,一定不含有Ba2+、CO32-、SiO32-,不能确定是否含有Fe3+,最好选择KSCN溶液对Fe3+离子进行检验,答案选②。
;溶液E为HNO3,气体F为NH3,E与F反应生成I为NH4NO3,含有的化学键类型有离子键和极性共价键;(4)根据题中提供的离子,前面已排除SiO32-的存在,则在过量氢氧化钠作用下得到的溶液H,通入过量二氧化碳后能产生沉淀K,K应该为氢氧化铝,则溶液H中含有偏铝酸根离子,故溶液X中含有A13+,转化⑦的离子方程式为[Al(OH)4]ˉ + CO2 = HCO3ˉ + Al(OH)3↓或AlO2ˉ+2H2O+ CO2 = HCO3ˉ + Al(OH)3↓;(5)综上可知,溶液中一定含有Fe2+、A13+、NH4+、NO3ˉ、SO42-,一定不含有Ba2+、CO32-、SiO32-,不能确定是否含有Fe3+,最好选择KSCN溶液对Fe3+离子进行检验,答案选②。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间的转化关系如图所示(部分产物已略去),下列说法正确的是( )

A. 若A为AlCl3溶液,B可能为氨水,反应①的离子方程式为:A13++4NH3·H2O=AlO2+ 4NH4++2H2O
B. 若A为Fe,B可能为稀硝酸,反应②的离子方程式为: 3Fe+8H++2NO3=3Fe2++2NO↑+4H2O
C. 若A为NaOH溶液,B可能为CO2,可用Ca(OH)2溶液鉴别C、D溶液
D. 若A为Cl2,B可能为NH3,实验室可用加热固体C的方法制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入2molA和1molB发生反应:2A(g)+B(g) ![]() 3C(g)+D(g)达到平衡时,C的浓度为amol/L.若维持容器体积和温度不变,按下列四种配比为起始物质,达平衡后,C的浓度仍为amol/L的是( )
3C(g)+D(g)达到平衡时,C的浓度为amol/L.若维持容器体积和温度不变,按下列四种配比为起始物质,达平衡后,C的浓度仍为amol/L的是( )
A. 4molA + 2mol B B. 2molA + 1molB + 3molC + 1molD
C. 3molC + 1molD + 1molB D. 3molC + 1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,X,Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的原子结构示意图为;化合物BA4的电子式为 .
(2)化合物Y2X2中含有的化学键类型有(填序号).
A.离子键
B.极性共价键
C.非极性共价键
D.氢键
(3)化合物A2X和A2Z中,沸点较高的是(填化学式),其主要原因 .
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的曲线: 表示其他条件一定,2NO + O2![]() 2NO2(该反应为放热)反应达到平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点, 其中表示未达到平衡状态,且 v正>v逆 的点是( )
2NO2(该反应为放热)反应达到平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点, 其中表示未达到平衡状态,且 v正>v逆 的点是( )
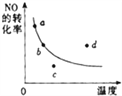
A. a点 B. b点 C. c点 D. d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. H2O2中加入MnO2, 产生O2的速度加快
C. 3H2 (g)+N2 (g) ![]() 2NH3 (g),ΔH< 0反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
2NH3 (g),ΔH< 0反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
D. 氨水应密闭保存、放置于低温处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO4在水溶液中能够完全电离出H+、Na+、和SO42- 。下列对于NaHSO4的分类中不正确的是
A.NaHSO4是盐 B.NaHSO4是酸式盐
C.NaHSO4是钠盐 D.NaHSO4是酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com