
【题目】可用如侧示意图象表示的是
反应 | 纵坐标 | 甲 | 乙 |
| |
A | 等质量的钾、钠分别与水反应 | H2的质量 | 钠 | 钾 | |
B | 相同质量的氨气在同一恒容容器发生2NH3 | NH3的转化率 | 500 | 400 | |
C | 体积比为1:3的N2、H2在体积可变的恒压容器中发生2NH3 | NH3的浓度 | 活性高的催化剂 | 活性一般的催化剂 | |
D | 2molSO2与1molO2在同温下发生2SO2+O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. A B. B C. C D. D
【答案】A
【解析】
A、钾的活泼性大于钠,等质量的钾、钠分别与水反应,钾反应快、生成氢气少;
B、温度越高反应速率越快,正反应吸热,升高温度平衡正向移动,NH3的转化率增大;
C、催化剂能使反应速率加快,但不能使平衡移动;
D、增大压强反应反应速率加快,增大压强,2SO2+O2![]() 2SO3平衡正向移动,SO3物质的量增大。
2SO3平衡正向移动,SO3物质的量增大。
A、钾的活泼性大于钠,等质量的钾、钠分别与水反应,钾反应快、生成氢气少,所以甲表示钠、乙表示钾,故A正确;
B、温度越高反应速率越快,正反应吸热,升高温度平衡正向移动,NH3的转化率增大,图像是  ,故B错误;
,故B错误;
C、催化剂能使反应速率加快,但不能使平衡移动,图像为 ,故C错误;
,故C错误;
D、增大压强反应反应速率加快,增大压强,2SO2+O2![]() 2SO3平衡正向移动,SO3物质的量增大,图像是
2SO3平衡正向移动,SO3物质的量增大,图像是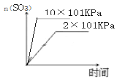 ,故D错误。
,故D错误。


科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
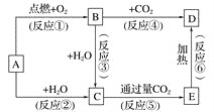
请填写下列空白:
(1)写出化学式:A____,B____,C_____,D____,E____。
(2)以上反应中,属于氧化还原反应的有____________(填写编号)。
(3)A→C反应的离子方程式是________。
(4) B→C反应的化学方程式是____________。
(5)E→D反应的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水.请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________。
(2)④、⑤、⑥、⑦四种溶液中NH![]() 浓度由大到小的顺序是(填序号)_______________。
浓度由大到小的顺序是(填序号)_______________。
(3)将③和④按体积比1∶2混合后,混合液中各离子浓度由大到小的顺序是:__________________。
(4)已知t ℃时,KW=1×10-13,则t ℃(填“>”、“<”或“=”)________25℃。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某杀菌药物M的合成路线如下图所示。

回答下列问题:
(1)A中官能团的名称是_______________。B→C的反应类型是__________________。
(2)B的分子式为________________________。
(3)C→D的化学方程式为__________________________。
(4)F的结构简式为___________________________。
(5)符合下列条件的C的同分异构体共有____________种(不考虑立体异构);
①能发生水解反应;②能与FeCl3溶液发生显色反应。
其中核磁共振氢谱为4组峰的结构简式为_______________(任写一种)。
(6)请以![]() 和CH3CH2OH为原料,设计制备有机化合物
和CH3CH2OH为原料,设计制备有机化合物 的合成路线(无机试剂任选)_______________。
的合成路线(无机试剂任选)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:
MnO2+![]() Zn +(1+
Zn +(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O
ZnSO4[Zn(OH)2]3·xH2O
其电池结构如图1所示,图2是有机高聚物的结构片段。


下列说法中,不正确的是
A. 碳纳米管具有导电性,可用作电极材料
B. 放电时,电池的正极反应为:MnO2+e+H+==MnOOH
C. 充电时,Zn2+移向Zn膜
D. 合成有机高聚物的单体是:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在人类生产生活中具有十分重要的作用,其中锂离子电池与太阳能电池占有很大比重。太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)基态亚铜离子中电子占据的原子轨道数目为____________。
(2)若基态硒原子价层电子排布式写成4s24px24py2,则其违背了____________。
(3)下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是_______(填标号)。

(4)元素X与硅同主族且原子半径最小,X形成的最简单氢化物Q的电子式为_____,该分子其中心原子的杂化类型为_____。写出一种与Q互为等电子体的离子______。
(5)与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O.其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是__________(填选项字母)。

A 离子键 B 共价键 C 金属键 D 范德华力 E 氢键
(6)GaAs的熔点为1238℃,密度为ρg·cm3,其晶胞结构如图所示。已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为____,GaAs的熔点____(填“高于”或“低于”)GaN。Ga和As的摩尔质量分别为MGa gmol1和MAs gmol1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳﹣12 原子和碳﹣13 原子的中子数相同
B.KMnO4 和 K2 MnO4 中有相同的原子团
C.Fe2+和 Fe3+都属于铁元素,核外电子数不同
D. 和
和 化学性质相似
化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系正确的是
A. 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
B. 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
C. 碳酸钠溶液具有碱性,可用于治疗胃酸过多
D. 氯化铁溶液呈酸性,可用于蚀刻铜电路板
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com